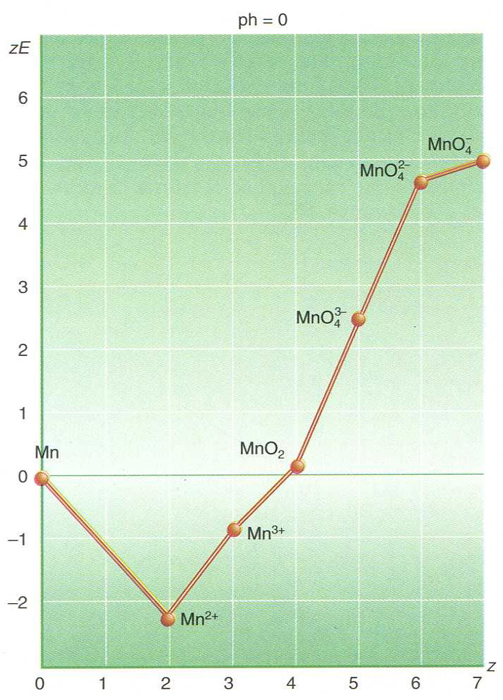
A cada espècie correspon un punt d’abscissa z (nombre d’oxidació que hi té l’element) i d’ordenada -ΔG°/F = zE (ΔG° essent l’entalpia lliure de formació estàndard de l’espècie en medi aquós, E el potencial normal de reducció del parell que forma amb l’element, i F el faraday). Els diagrames, que poden variar amb el pH, permeten de deduir els potencials redox normals entre les espècies representades i mostren les que són inestables a la desproporcionació. Combinats amb els altres elements, aclareixen totalment les reaccions d’oxidoreducció en solució aquosa de l’element considerat, en la mesura que aquestes reaccions són cinèticament reversibles i que hom té en compte la formació de complexos i de composts insolubles.
m
Química