Té un sol isòtop natural: el núclid 59, i 10 núclids artificials: 54, 55, 56, 57, 58 i 58 m, 60 i 60 m, 61 i 62. Metall blanc, dúctil i mal·leable, descobert per Georg Brandt el 1735.
Graus d’oxidació del coballt: el +3, el +2, que és l’únic estable per a les sals simples en solució, el +1, que ha estat assenyalat per Manchot el 1926, i el +4, que es dóna segurament en l’òxid CoO2 i en alguns complexos. N'hi ha dues varietats al·lotròpiques: la varietat α, que cristal·litza en el sistema hexagonal compacte (c/a = 1,6), estable a les temperatures ordinàries i que es transforma lentament per sobre de 450°C en l’altra varietat, la β, de tipus cúbic de cares centrades (a = 3,56 Å). Com el ferro i el níquel, el cobalt és ferromagnètic: punt de Curie cap a 1 150°C. Inalterable en una atmosfera d’aire sec o humit a les temperatures ordinàries, s’oxida lentament quan és roent i es recobreix aleshores probablement d’una capa d’òxid salí Co3O4. Absorbeix, com el ferro i el níquel, una certa quantitat d’hidrogen, variable segons el seu estat físic. Els halògens l’ataquen en calent. La tensió d’oxidoreducció corresponent a l’equilibri Co/Co2+ és, en volts, de -0,28 + 0,03 log [Co2+]. És, doncs, fàcilment atacat pels àcids diluïts, però no tant com el ferro. La reacció és lenta amb HCl i amb H2SO4; es formen les sals cobaltoses corresponents i hom obté hidrogen; és molt més viva amb HNO3, que és reduït a l’estat de vapors nitrosos. L’àcid nítric fumant i d’altres oxidants el fan esdevenir passiu. Amb l’òxid de carboni, sota pressió, dóna dos derivats carbonílics que posseeixen propietats catalítiques interessants: l’octocarbonildicobalt, Co2(CO)8, i el dodecacarboniltetracobalt, Co4(CO)12. Els minerals més importants del cobalt són l'esmaltina, CoAs3, i la cobaltita , CoAsS, que es donen gairebé sempre barrejades amb níquel, la linneïta, Co3S4, i la carrol·lita, CuCo2S4, composts sulfurats que, juntament amb l'heterogenita, composta d’òxids impurs, es donen en els minerals de coure del Congo amb un contingut total en cobalt del 9%, i l’ asbolita , mineral de Nova Caledònia que conté del 3 al 4% d’òxid de cobalt al costat de molts d’altres (òxids de ferro, de níquel, de manganès, etc).
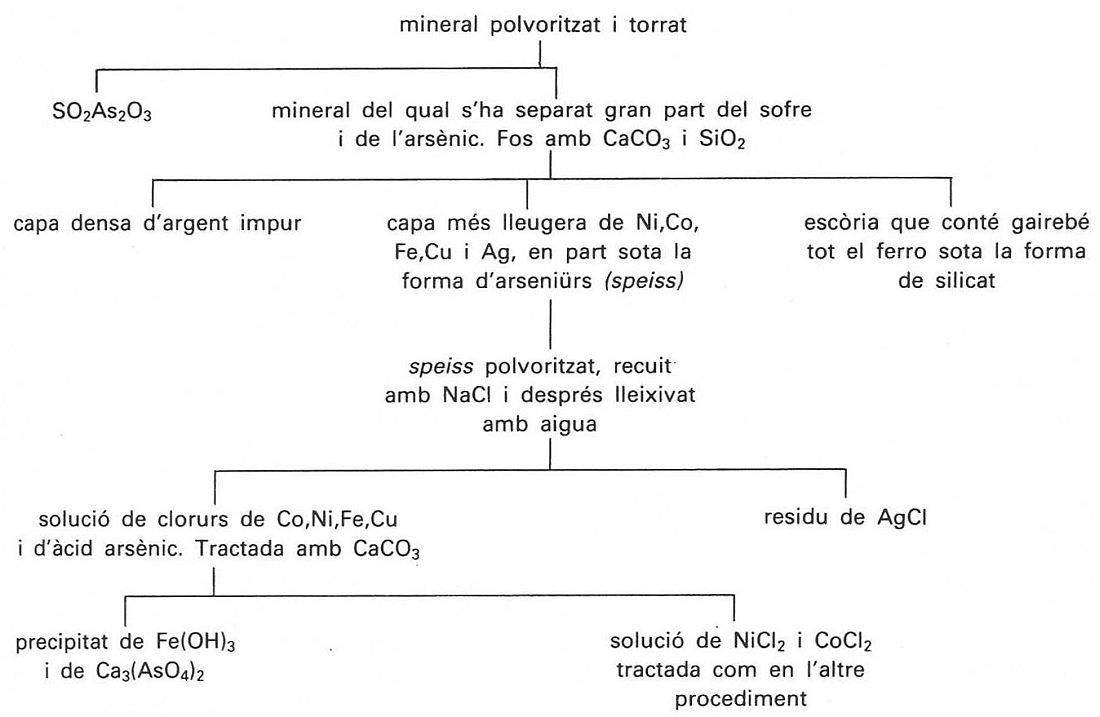
Extracció de cobalt d’un mineral arsenífer i argentífer
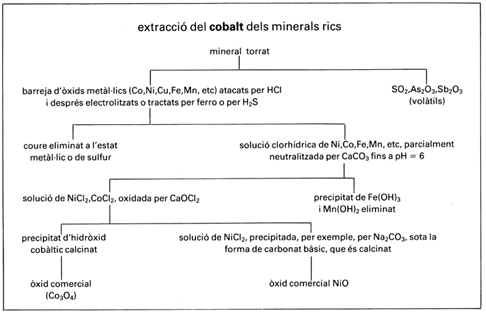
La metal·lúrgia del cobalt és llarga, complexa i cara; els mètodes emprats depenen de la composició del mineral, que conté sempre uns altres nombrosos elements, però bàsicament són dos: un per als minerals rics i un altre per als minerals pobres. En el primer, després d’una cocció que en transforma els sulfurs, els arsenurs i els antimonurs en òxids, el mineral és dissolt dins àcid clorhídric; la presència de coure és eliminada per cementació (precipitació sobre ferro), per electròlisi o per mitjà del sulfur d’hidrogen; per l’acció de carbonat de calci hom obté la precipitació de l’hidròxid fèrric; l’addició de clorur de calci en la nova solució provoca la hidròlisi de la sal cobàltica obtinguda i la precipitació de l’hidròxid cobàltic; la calcinació del precipitat permet l’obtenció de l’òxid comercial, de fórmula Co3O4, que conté encara un percentatge ínfim de níquel. En el segon procediment, després d’ésser enriquit per flotació i sotmès a una forta torrefacció per eliminar-ne la major part del sofre i de l’arsènic, el mineral és fos en presència de sílice i de carbonat de calci, operació que permet la separació del ferro sota la forma de silicat; els metalls restants són separats en dues capes: l’una, més densa, conté gairebé tot l’argent, i l’altra, més lleugera (speiss), el níquel, el cobalt i el coure, sota forma d’arsenurs; el speiss, solidificat i polvoritzat, és recuit en presència de clorur de sodi i hom en recull els clorurs per extracció aquosa, el coure es precipita per cementació i el cobalt és, per fi, separat de la solució final de la mateixa manera que en el primer mètode. L’òxid de cobalt així obtingut encara resulta inutilitzable com a colorant a causa de la presència de petites quantitats de níquel (fins al 3%). Un mètode de purificació permet, per electròlisi del clorur de cobalt, l’obtenció del metall en un alt grau de puresa (contingut de Ni ferro-cobalt, amb el 34% de cobalt i d’interessants propietats magnètiques, emprat per a la fabricació de peces polars d’electroimants o d’imants permanents, el Stellite (55% Co, 25% W, 15% Cr, 5% Mo), aliatge duríssim amb el qual hom fabrica eines de tall, el kanthal, aliatge de crom, ferro, alumini i cobalt, per a la fabricació de resistències elèctriques; com a element d’aliatge en pulverimetal·lúrgia, el cobalt és fonamental per a relligar els carburs de tungstè, de titani i de molibdè que componen les plaquetes de metall dur (vídia), àleps dels turboreactors o les cambres de combustió de les turbines de gas. El cobalt serveix també per a la preparació de pintures i esmalts: les indústries de la ceràmica i del vidre consumeixen grans quantitats de smalt, silicat blau de potassi i cobalt; el blau de Thenard és un aluminat de cobalt, i el verd de Rinmann, una barreja d’òxids de zinc i de cobalt; nombroses sals de cobalt són emprades com a assecant en certes pintures i l’òxid és emprat per a augmentar l’adherència de les capes superiors dels esmalts. La meitat de la producció mundial de cobalt prové de la República Democràtica del Congo; els altres productors importants són el Canadà, els EUA, Finlàndia, el Marroc i Zàmbia. El 75% de la producció és utilitzada en la metal·lúrgia, i la resta és sobretot emprada en les indústries de la ceràmica i del vidre sota la forma de composts. El cobalt forma un gran nombre de complexos amoniacals, els més importants dels quals són les cobaltammines. El cobalt és un oligoelement necessari per a la vida cel·lular i especialment per a l'hematopoesi; entra en la composició de la vitamina B12, factor antiperniciós de l’anèmia.
Propietats físiques del cobalt
| Co | |
| nombre atòmic | 27 |
| pes atòmic | 58,933 |
| estructura electrònica | [Ar] 3d74s2 |
| valència | +2, +3 |
| pes específic (a 20ºC) | 8,9 |
| punt de fusió | 1 495ºC |
| punt d’ebullició | 2 870ºC |
| conductivitat tèrmica (del sòlid policristl·lí, a 25ºC) | 1,00 W/cm·K |
| resistivitat elèctrica (a 20ºC) | 6,24 μΩ·K |
| radi iònic (Co+2) | 0,73 Å |
| radi iònic (Co+3) | 0,63 Å |
| potencials d’ionització, en eVI | 7,86 |
| potencials d'ionització, en eVII | 17,06 |
| potencial de reducció, en V: Co+2 + 2e ⇌ Co | -0,28 |