Aquesta funció, introduïda per Hammett, és definida, per a una base de Brønsted elèctricament neutra B, per l’expressió

(on a i és l’activitat i f i el coeficient d’activitat de i : f i = a i /C i , essent C i la concentració de i ) i pot ésser calculada per la fórmula
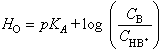
(on tant K A , que és la constant d’acidesa en el solvent S de l’àcid HB + , conjugat de B, com C B , i C H B + , que són concentracions, són experimentalment accessibles). Si hom pot admetre (tal com féu Hammett, basant-se en fets experimentals), que f B / f H B + depèn només de la càrrega elèctrica de B però no de la seva natura química, H O és funció només de l’acidesa i els seus valors permeten comparar, en un mateix solvent, àcids de diferent natura i a distintes concentracions. El càlcul de H O és simple, ja que, utilitzant un indicador com a base, C B / C H B + , pot ésser determinat colorimètricament. Tal com hom dedueix de la definició, en solució aquosa diluïda la funció d’acidesa és confosa amb el pH . La consideració d’aquesta funció ha conduït a resultats interessants en l’estudi cinètic de les reaccions acidocatalitzades.