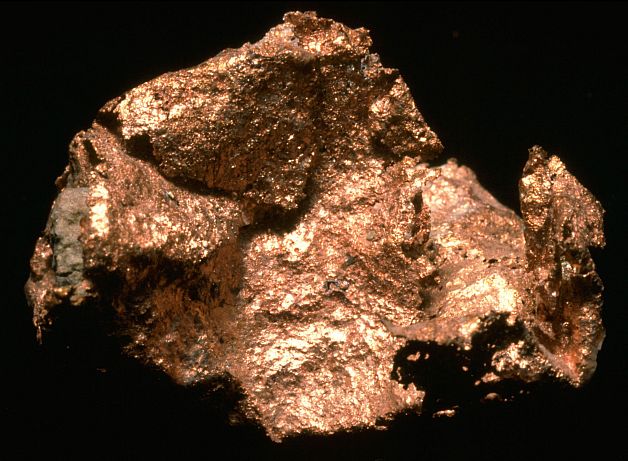L’afinament electrolític és, però, el procediment més corrent: la solució electrolitzada conté d’un 15 a un 20% de sulfat de coure (CuSO₄, 5H₂O) i del 5 al 8% d’àcid sulfúric; els ànodes de coure brut i els càtodes de coure pur són disposats en paral·lel dins una cel·la electrolítica; els metalls més electropositius que el coure són solubilitzats, el plom precipita en forma de sulfat i els metalls nobles constitueixen el fang anòdic juntament amb el sofre, el seleni i el tel·luri. El coure catòdic té un grau de puresa elevat (des del 99,9% fins al 99,98%), però conté gasos, i per això, ha d’ésser refós. El coure és un element d’activitat química mitjana: es combina amb tots els elements no metàl·lics, llevat de l’hidrogen, el bor, el carboni i el nitrogen. Amb l’oxigen la reacció és lenta i superficial a la temperatura ambient, i produeix l’òxid Cu₂O; en calent (t°>100°C), la reacció és més ràpida, i hom obté una mescla de Cu₂O i CuO. Per l’acció dels agents atmosfèrics el coure es recobreix d’una capa protectora, el >100°C), la reacció és més ràpida, i hom obté una mescla de CuO i CuO. Per l’acció dels agents atmosfèrics el coure es recobreix d’una capa protectora, el verdet, barreja de sals bàsiques de coure, carbonat i sulfat sobretot, el darrer dels quals prové de l’oxidació del sofre dels combustibles domèstics. Quan és roent el coure crema amb incandescència dins del clor i també dins de vapors de brom, elements que, juntament amb el fluor, l’ataquen lentament a la temperatura ordinària. Triturats dins d’un morter, el coure i el sofre es combinen amb incandescència; el diagrama d’equilibri S/Cu mostra l’existència dels composts CuS, Cu₂S i d’una fase d’estructura cúbica de cares centrades, la digenita (Cu₉S₅). Amb el fòsfor, l’arsènic i l’antimoni el coure dóna, per síntesi directa, diferents composts, els més coneguts dels quals són Cu₃P, Cu₃As, Cu₂Sb i Cu₃Sb. El sistema coure/silici comporta un gran nombre de fases, la més coneguda de les quals és Cu₃Si. L’aigua pura no té cap acció sobre el coure. Les tensions normals dels sistemes Cu →Cu⁺ + e- (0,525 V) i Cu →Cu⁺⁺ + 2e- (0,345 V) situen el coure enmig dels metalls nobles. Els hidràcids l’ataquen amb despreniment d’hidrogen, i l’àcid sulfúric ho fa molt lentament en fred, però ràpidament en calent; concentrat i a temperatura elevada (t°>130°C) aquest mateix àcid funciona aleshores com a oxidant, i l’atac produeix anhídrid sulfurós, SO₂:

L’element natural del coure és una barreja dels dos núclids 63(69,1%) i 65 (30,9%). Hom en coneix nou isòtops artificials: del 58 al 62, el 64 i del 66 al 68. La proporció de coure a l’escorça terrestre és del 0,01%, aproximadament. Cristal·litza en el sistema cúbic, bé que poques vegades forma cristalls; sovint es presenta en formes arborescents o masses filiformes. De color de rosa clar, en oxidar-se en presència de l’aire agafa un color marró. Els minerals de coure es divideixen en dos grups: els minerals sulfurats i els anomenats metamòrfics o oxidats. Dels primers, hom en coneix els sulfurs simples, com la calcosina i la covel·lina. Els minerals sulfurats es donen en nombroses regions d’Amèrica (els EUA, el Perú), d’Àfrica (Zàmbia) i d’Europa (Noruega, Espanya i Alemanya). Els minerals metamòrfics són el coure natiu, força rar (llac Superior, als EUA), els òxids (cuprita i tenorita) i les sals insolubles (malaquita al Zaire, Mèxic, etc., i atacamita al desert d’Atacama, etc.). La metal·lúrgia del coure comprèn un procediment en sec, que és aplicat als minerals rics o enriquits per flotació, i un tractament humit, destinat als minerals pobres. En el procediment per via seca, el coure natiu és simplement fos, els minerals oxidats són reduïts pel coc, i el metall és separat de la ganga per decantació. Els minerals a base de sulfurs són sotmesos a una fusió, seguida d’una oxidació; gairebé tot el sulfur de ferro és transformat en òxid, i aquest, en silicat per acció de la sílice continguda en la ganga; l’excés de sofre i, eventualment, l’arsènic i l’antimoni, són eliminats sota forma d’òxids volàtils, segons les següents equacions:
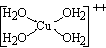
Hom efectua la segona operació dins un convertidor: d’entrada la mata és sotmesa a una oxidació en presència de sílice, per tal d’eliminar-ne el ferro restant sota forma de silicat, i una oxidació ulterior transforma el sulfur de coure en òxid que reacciona, a mesura que es va formant, amb el sulfur restant, per donar coure brut: 2Cu2O+Cu2S ⇄ 4Cu+SO2.
En el procediment per via humida, el coure dels minerals pobres és solubilitzat sota forma de sulfat; si el mineral és a base de sulfur, una torrefacció moderada a 450-480°C oxida el sulfur de ferro a sulfat fèrric, que transforma el sulfur de coure en sulfat soluble. Per a extreure el coure de les solucions obtingudes hom utilitza, sovint, el procediment dit de cementació: posant en presència de ferro l’ió Cu⁺⁺, aquest és reduït i apareix sota forma metàl·lica, mentre que el ferro és solubilitzat. En sigui quin vulgui l’origen, el coure ha d’ésser sotmès a un afinament. En l’afinament per via seca, que té lloc en un forn, els elements no metàl·lics són eliminats sota la forma d’òxids volàtils, els metalls més oxidables que el coure són transformats en silicats i recollits en l’escòria, i els metalls preciosos es concentren en el bany, de densitat elevada; aquest procediment produeix un coure amb una puresa del 99%.
Cu+2H2SO4 → CuSO4+SO2+2H2O; l’àcid nítric diluït l’ataca ràpidament, amb producció d’òxids de nitrogen, NO principalment: Cu+8(H+NO3-) → 3(Cu2++NO3-)+2NO+4H2O
El sulfur d’hidrogen ataca el coure, sobretot en presència d’aire: H2S+Cu+1/2O2 → CuS+H2O
els àcids orgànics també l’ataquen i, sovint, es formen sals bàsiques; una solució d’amoníac agitada en presència d’aire solubilitza el coure a l’estat d’ions tetraaminocoure (Cu⁺⁺) de color blau: Cu+4NH3+H2O+1/2O2 → Cu(NH3)4+++2HO-
El coure en els éssers vius. Aplicacions del coure i compostos derivats
Pel que fa als éssers vius, el coure es dóna en petites quantitats en les plantes verdes, sobretot. La presència de traces de coure sembla indispensable per a la vida: el coure intervindria en la formació de l’hemoglobina per a mobilitzar el ferro dins de l’organisme. La sang de nombrosos invertebrats conté, juntament amb l’hemoglobina o en lloc seu, un pigment respiratori compost de coure, que els insensibilitza, gairebé totalment, a l’intoxicació per monòxid de carboni. A dosis fortes les sals de coure solubles són tòxiques: la dosi mortal per als animals superiors, sota forma d’injecció intravenosa, se situa als voltants d’1,5 mg/kg; per via bucal l’home pot absorbir-ne fins a 100 mg sense perill. Les sals de coure són fortament tòxiques per als organismes inferiors, i hom les empra de manera habitual per a combatre les algues i els bacteris de les aigües potables i per a lluitar contra certes malalties dels arbres fruiters i, sobretot, de la vinya. Les utilitzacions industrials del coure es basen en les seves propietats fonamentals: conductivitat elèctrica elevada (cables, fils conductors, motors, interruptors, etc), excel·lent conductivitat tèrmica (calderes, alambins, estris de cuina, etc), acceptable resistència a la corrosió (canalitzacions, teulades, etc); el coure pur és emprat sobretot en la indústria elèctrica. Sovint, per tal de millorar-ne les propietats mecàniques (resistència a la tracció, duresa, etc) el coure és aliat amb certs elements, però en molt petita proporció, a fi de conservar una alta conductivitat: 0,5% d’arsènic, o 0,1% d’argent, o 0,8% de cadmi, etc. Hom pot treballar fàcilment el coure per deformació en fred (aram); per contra, és un metall difícil d’emmotllar a causa de la retracció i del despreniment dels gasos dissolts en el metall calent, durant el refredament; aquesta dificultat desapareix en els seus aliatges, bronze, llautó i cuproníquel. El coure forma dues sèries de composts que corresponen als graus d’oxidació +1 (cuprós) i +2 (cúpric); hom també en coneix uns quants composts inestables corresponents al grau +3; les úniques sals cuproses (Cu+) estables en medi aquós són els composts poc solubles (Cu+Cl-, Cu+CN-) i els complexos que hom en pot obtenir, generalment incolors; l’ió Cu++ és incolor a l’estat anhidre, però esdevé blau o verd en contacte amb l’aigua, segons la concentració i l’acidesa de les solucions; els complexos cúprics són generalment tetracoordinats, com l’ió blau

L’oxidació de les solucions cúpriques en medi bàsic condueix als complexos de l’ió Cu+++, de color vermell o marró.
El coure en la història humana
El coure fou el primer metall utilitzat industrialment. Ha donat nom a un període de la prehistòria, l’Eneolític, dit també Calcolític. La descoberta d’aquest metall tingué lloc al Pròxim Orient, i les primeres etapes no són gaire conegudes. Hi ha mostres de l’ús del coure a Sialk (Iran) i a Anatòlia a la primeria del IV mil·lenni; durant aquell mateix mil·lenni s’estengué a tot el Pròxim Orient asiàtic i a Egipte. En una primera etapa fou treballat directament a martell, partint del coure natiu, però molt aviat hom descobrí el sistema de la fosa i de la fabricació d’objectes amb motlle. Els dos grans centres d’explotació del mineral foren l’Iran i Xipre. L’ús del coure s’estengué per la resta de la Mediterrània entre el 2500 i el 2000 aC, que és quan hom el començà a treballar als Països Catalans (hom ha trobat una mina de coure prehistòrica a Riner, al Solsonès). Des de la fi del III mil·lenni, un dels grans centres de l’explotació del mineral a Occident fou Andalusia. També durant el III mil·lenni fou descobert, igualment al Pròxim Orient, el bronze, aliatge de coure i estany.
El coure com a producte industrial
A l’edat mitjana les mines alemanyes foren les grans fornidores de coure, però posteriorment foren superades per les de Cornualla. Al segle XIX la preeminència de la producció passà a les mines andaluses de Riotinto, que, controlades per interessos britànics, feren de la Gran Bretanya el primer productor mundial. L’augment de la demanda provocat per l’electrificació capgirà el mercat tradicional i féu créixer la producció, la qual, l’any 1880, fou d’unes 200.000 tones, provinents sobretot dels EUA, que havien posat en explotació els grans jaciments d’Arizona, Montana i Utah. En començar el segle XX les companyies dels EUA obriren l’explota.ció de les grans reserves del Congo Belga i de Xile. Les necessitats bèl·liques n'ocasionaren un augment extraordinari del consum. El 1946 l’extracció de mineral., excloent-ne la soviètica, de la qual hom desconeix les xifres, però que podia haver arribat a unes 200.000 t, fou d’1,7 milions de t, no gaire inferior a la de la preguerra. El 1955 hom atenyé els 3 162 milions de t. El 1970 la producció mundial de mineral fou de 6.800.000 t i el 1974 s’havia incrementat en un 13%. Nou anys després, en plena crisi, l’increment havia estat només d’un 7% escàs. L’Amèrica Llatina n'obtingué (1983) el 21,7% només amb tres grans productors: Xile i el Perú, i Mèxic; els EUA i el Canadà, un 20,2% més. A l’Àfrica, entre Zàmbia, el Zaire i Sud-àfrica en produeixen un 15% del total mundial, i l’URSS ocupa el segon lloc per estats, darrere de Xile i davant dels EUA. La producció de lingots (coure blister, amb el 95-98% de puresa) ha tingut una evolució paral·lela a la del metall contingut en els minerals extrets. La producció d’1,85 milions de t, el 1946, superà aviat les xifres prebèl·liques, i el 1983 arribava a 8,51 milions de t. Encara que la producció s’ha incrementat, l’augment va essent any rere any més reduït. Aquest canvi de ritme, que hom atribueix genèricament a la “crisi”, en el cas del coure s’ha combinat amb una substitució parcial per d’altres matèries primeres: l’alumini el substitueix en els radiadors d’automòbil, els plàstics en les canonades i les fibres òptiques en telecomunicacions. Els principals productors de coure de foneria són aproximadament els productors de mineral, però els llatinoamericans no figuren al primer lloc: el 1983, Xile (tercer del món) i el Perú atenyeren el 15,9% de la producció mundial; els EUA i el Canadà, el 16,4%; els africans, el 14,4%; els soviètics (primer del món), el 15%; i els asiàtics, el 14,8% (el Japó, segon del món). El comerç internacional de coure es basa, més que no pas en el mineral en brut, en metall fos en lingots. L’afinament del coure requereix una tècnica molt complexa, pròpia dels països industrialitzats. Així, els 9 754 milions de t obtinguts el 1980 procediren en el 23,1% dels EUA i el Canadà; en el 14,9% de l’URSS, segon productor, per estats, darrere dels EUA i davant del Japó, que amb la Xina en produeix el 13,3%; i tres productors europeus (Bèlgica, l’Alemanya Federal i Polònia), que n'obtenen el 13,8%, davant els llatinoamericans Xile i Perú (10,7%) i els africans.
Malgrat l’antiguitat de la seva extracció (de l’inici de l’edat del bronze prop de Riner, al Solsonès), i metal·lúrgia (el metall beneficiat més antigament), el coure no ha assolit mai gaire importància als Països Catalans. Als segles XVIII i XIX abundaven les prospeccions de minerals de coure a la Serralada de Marina (massissos de Begur, les Gavarres, Montnegre) i a la contrada volcànica d’Olot i hom n'explotava al llarg del Pirineu oriental (Queralbs, Ribes i Pardines; Beget, Maçanet de Cabrenys, Sant Llorenç de la Muga, Colera, la Presta, la Menera, Canavelles), però els rendiments eren minsos. Al començament del segle XX hom parla de jaciments a Collserola, i, com a importants, de dues mines d’Hortsavinyà (Montnegre), el mineral extret de les quals no arribava a les 14 tones anuals de metall contingut. La metal·lúrgia s’havia mantingut a les fargues del Solsonès, als Pirineus, Torelló i voltants fins al principi del segle XX. Avui, no sempre destriada de la d’altres metalls no ferris, n'hi ha només als voltants de Barcelona (Esplugues de Llobregat, Santa Perpètua de Mogoda, Montcada i Reixac, Sant Vicenç dels Horts, etc.) i de València (coure blister amb mineral importat de l’estranger o amb coure vell, però hom no n'obté d’electrolític).