Si hom el frega amb la mà se’n desprèn una lleugera olor. Normalment actua amb valència +2 i +4, malgrat que també es pot presentar amb —4. Hom en coneix deu núclids naturals: 112 (0,9%), 114 (0,6%), 115 (0,4%), 116 (14,1%), 117 (7,5%), 118 (24%), 119 (8,6%), 120 (33%), 122 (4,8%) i 124 (6,1%), i onze núclids artificials: 108, 111, 113, 117m, 119m, 121 i 121m, 123, 125, 126 i 127. També ren el nom de júpiter, provinent del déu romà Júpiter.
Esmentat per Homer i emprat pels contemporanis de Plini per a recobrir els objectes de coure i de llautó, l’estany fou molt utilitzat durant l’edat mitjana, sobretot com a substitutiu, més econòmic, de l’argent; la vaixella d’estany era la vaixella ordinària de la burgesia; els pesos eren també d’estany, i l’Església n'admetia l’ús per a la fabricació de vasos sagrats. Durant els segles XVI i XVII la professió d’estanyer continuà essent molt difosa: hom obtenia les peces de valor, recercades encara avui dia, en motlles de metall o de pedra tallada; per als plats o plates ordinaris hom emprava motlles de sorra. L’art de l’olleria d’estany fou substituït al segle XX pel de la ceràmica.

Propietats físiques de l’estany
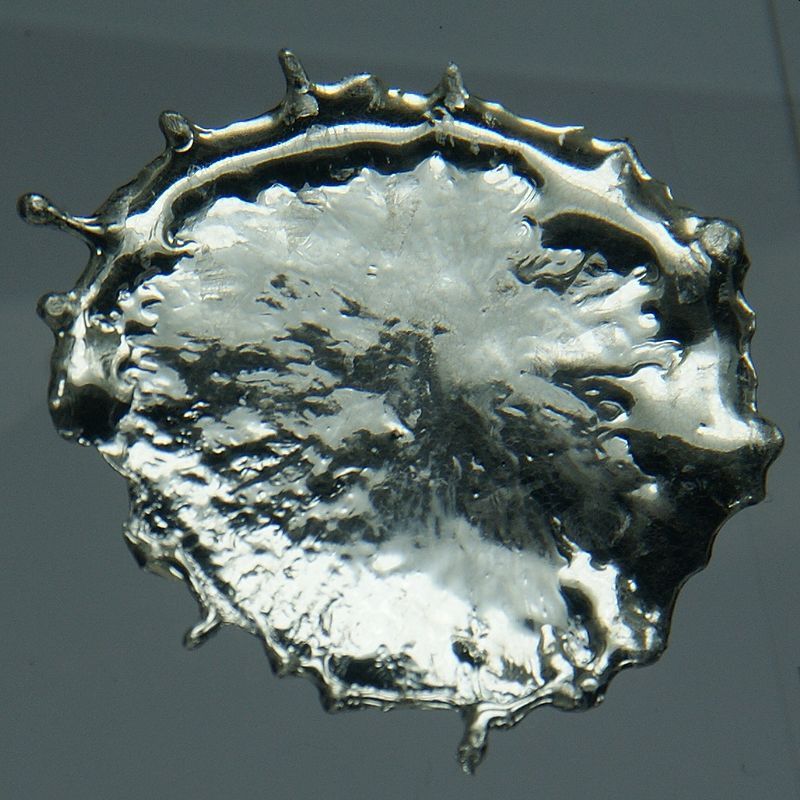
El metall ordinari o estany blanc (Sn β), mitjanament dur però molt mal·leable, cristal·litza en el sistema tetragonal i hom l’obté per solidificació de l’estany fos i també, sota la forma de ramificacions cristal·lines (arbre de Júpiter), per reducció d’una sal estannosa pel zinc. El doblegament d’una vareta d’estany colat és acompanyat d’un cruiximent característic, anomenat crit de l’estany, degut a la fricció interna dels cristalls. La varietat β es transforma en estany α o estany gris, cúbic, molt menys dens, si hom el refreda enèrgicament. La transformació reversible es comença a produir a +13°C, però la seva velocitat en el sentit α →β és gairebé nul·la a les temperatures ordinàries en la natura. Com que és menys dens, l’estany α augmenta de volum i es polvoritza, fenomen conegut des de temps antic pel nom de “pesta de l’estany”, però que és molt excepcional. L’estany blanc és metaestable. Escalfant l’estany β (t > 161°C) hom obté una altra varietat enantiotròpica, l'estany fràgil o estany γ, ortoròmbic, que hom pot polvoritzar fàcilment a martellades i que es fon a 232°C. El comportament químic i les propietats físiques de l’estany en fan un metall, però el potencial normal corresponent a la reacció Sn →Sn++ +2e, que és de —0,14 V, situa el seu feble poder reductor i l’apropa a certs metal·loides, com el silici. L’estany resisteix perfectament l’acció de l’aire, sec o humit; fos en contacte amb l’atmosfera, es recobreix ràpidament d’una capa grisenca, mescla d’estany i de diòxid; escalfant-lo més intensament es transforma en diòxid (SnO2). A 1.000°C el metall crema amb una flama blanca, fenomen que pot continuar produint-se dintre el vapor d’aigua, car l’estany redueix l’aigua. Els àcids diluïts l’ataquen molt poc a la temperatura ordinària. L’àcid clorhídric concentrat i calent el dissol ràpidament, com també els àcids nítric, sulfúric, etc. A la temperatura ordinària o en calent els composts alcalins, diluïts o concentrats, no tenen pràcticament cap acció sobre l’estany. A més del derivat d’hidrogen, en el qual posseeix el grau d’oxidació —4, hom en coneix dues sèries de derivats, els composts estannosos (Sn++) i els estànnics (Sn4+); tot i essent més estables que els composts corresponents del germani, els derivats estannosos conserven un caràcter reductor i s’oxiden fàcilment. Rar en estat natiu (sibèria, Austràlia), l’estany es presenta, sobretot, en forma d’òxid; el seu mineral més important és la cassiterita (SnO2), sovint mesclat amb wolframita i amb òxids de ferro i de manganès. Hom concentra el mineral polvoritzat per triatge magnètic, seguit d’un rentatge aquós, i, si cal, és sotmès a una fusió alcalina que permet la recuperació del tungstè. Per tal d’eliminar-ne el sofre, l’arsènic i l’antimoni, hom l’escalfa en medi clorurant o sulfatant i el sotmet a un rentatge aquós que n'elimina els clorurs i els sulfats solubles de certs metalls (Cu, Fe). El producte obtingut, l'estany negre, que conté un 75-85% de SnO2, és reduït a 1.200° pel carbó:SnO2 + 2C →2CO + Sn — 85 Kcal.
Una part de l’estany resta a les escòries, que hom recicla com a mineral; hom sotmet l’estany brut obtingut (99%) a una liquació, a una temperatura lleugerament superior a la de la fusió de l’estany (232°C), que elimina el ferro sota la forma d’un aliatge sòlid ferro-estany i, finalment, a l’acció oxidant d’un corrent d’aire, que n'elimina les impureses restants sota la forma de “crasses” que es formen a la superfície del bany. El metall així obtingut té una puresa del 99,9% i, a vegades, hom l’afina electrolíticament. El valor i la raresa de l’estany fan de la seva recuperació una operació remuneradora. Ateses la seva inalterabilitat i la seva resistència a la corrosió, hom empra l’estany per a la protecció de certs metalls (Cu, Fe). En la indústria alimentària és emprat sota la forma de tubs o de làmines i també per a la fabricació de llauna, que absorbeix més de la meitat de la producció de l’estany. En la indústria elèctrica hom l’empra per a estanyar fils conductors; en les indústries química i agrícola, per a fabricar peces, recobrir canalitzacions i per a obtenir els seus composts; en la indústria farmacèutica, per a tubs i altres recipients, i en la mecànica, per a l’obtenció de planxes i per a la protecció de certes làmines de plom. Polvoritzat, en solució col·loidal i juntament o no amb el seu òxid, l’estany és emprat com a vermífug i per a combatre la furuncolosi. L’estany serveix també per a fabricar nombrosos aliatges, sobretot bronze i antifricció. Aliat amb plom, permet d’obtenir diferents metalls per a soldadures: soldadura dels estanyers (45 a 65% de Sn), soldadura per a soldar el zinc (30 a 40% de Sn), soldadura pels plomers (25% de Sn), etc. Aliat amb l’antimoni (15 a 20%), que l’endureix, l’estany serveix per a fabricar aixetes per a la indústria química. Certs aliatges tenen una utilització molt ben definida: el metall de la reina (estany, antimoni, plom i bismut) i el metall anglès (estany + 10% d’antimoni + 2 a 3% de coure i de plom) són emprats per a fabricar coberts, cafeteres, etc. L’estany també és emprat per a obtenir aliatges que es fonen a una temperatura inferior a 100°C (aliatges de Newton, de Darcet, de Lipowitz i de Wood).