Les propietats típiques d’ambdós reactius desapareixen pel fet de la reacció, cosa que és interpretada com una neutralització mútua dels àcids i de les bases que dóna composts neutres tals com, per exemple, les sals. Aquestes dues propietats essencials van acompanyades, en general, d’altres de menys fonamentals (i no sempre presents), com el sabor àcid, l’activitat catalítica i la propietat —en solució aquosa— de dissoldre certes substàncies insolubles com els carbonats i molts metalls. A més, els àcids (i les bases) poden desplaçar-se mútuament de llurs composts correlativament a llurs forces.
El concepte d’àcid es remunta als primers temps de la química i ha experimentat en el curs dels segles variacions considerables. Per bé que hom hagi buscat reiteradament de relacionar-lo amb la composició, de fet ha derivat sempre d’uns criteris fenomenològics com els esmentats, és a dir, de l’aptitud per a reaccionar, amb determinades substàncies, d’una manera determinada. Per als alquimistes, els àcids eren les substàncies de propietats similars a les del vinagre, i a ells hom deu també la identificació d’uns altres composts, de propietats en certa manera oposades, que anomenaren àlcalis , per llur similitud amb les cendres de la fusta, i que són els que avui anomenem, de manera més general, bases. Al final del segle XVII, Robert Boyle caracteritzà ja els àcids per llur sabor i les propietats de dissoldre moltes substàncies, de precipitar el sofre de les seves solucions alcalines, d’enrogir el tornassol i de perdre les seves característiques al contacte dels àlcalis.
Antoine Lavoisier, el 1777, considerà erròniament que l’oxigen és un element comú a tots els àcids, la presència del qual produeix llur acidesa, i d’acord amb això creà, a partir del grec, el mot oxigen, que vol dir ‘generador d’acidesa’. La hipòtesi de Lavoisier és vàlida solament per als anomenats oxiàcids i, en efecte, pocs anys després, el 1787, Claude Berthollet demostrà que hi havia àcids que no contenien oxigen. L’any 1815, Humphry Davy (que havia elucidat la composició de dos hidràcids importants, l’àcid clorhídric i el iodhídric, composts formats només per un element electronegatiu i hidrogen) suggerí que l’element present en tots els àcids era probablement l’hidrogen. Aquesta idea s’anà imposant (malgrat l’opinió d’un químic tan important com Jörs Jakob Berzelius) i així, als criteris fenomenològics ja enunciats per Robert Boyle (que no són ni tots necessaris ni tots suficients), hom afegí el concepte que els àcids són substàncies que contenen en llur molècula un o més àtoms d’hidrogen que poden ésser substituïts per metalls (per reacció directa amb el metall o amb un òxid, hidròxid o carbonat metàl·lic). És a partir d’aquí que, conjuntament amb la teoria de la dissociació electrolítica, fou elaborada la primera teoria moderna dels àcids i bases, realment comprensiva i coherent, que és la teoria d’Arrhenius (1887).
Svante Arrhenius es basà en el fet que les propietats àcides es manifesten sobretot en solució aquosa i, prescindint dels fenòmens on no és així, definí els àcids com les substàncies que en solució aquosa donen ions H+: HA ⇌ H+ + A- i les bases com les que donen ions OH-: BOH ⇌ B+ + OH-.
En la teoria d’Arrhenius, una solució àcida és, doncs, una solució que conté ions H⁺, una solució bàsica la que conté ions OH- i una solució neutra la que no conté ni els uns ni els altres o, més exactament (quan es tracta de solucions aquoses), la que els conté tots dos en quantitats idèntiques però extremament febles. D’aquesta manera la identitat de moltes de les propietats de totes les solucions àcides (o de totes les solucions alcalines) resta perfectament explicada. L’acidesa o l’alcalinitat de les solucions poden, d’altra banda, expressar-se a partir dels valors numèrics de les concentracions (o de les activitats) dels ions H⁺ i OH-, i una manera còmoda de fer-ho és mitjançant el valor del pH.
El fenomen de la neutralització resta també explicat pel fet de la reacció H+ + OH- → H2O que és ràpida i pràcticament completa (ja que l’aigua és un compost gairebé gens dissociat) i dóna lloc a la formació d’una sal a partir dels ions A- i B⁺ restants. Les solucions de les sals són, doncs, en principi,
La teoria d’Arrhenius, malgrat la clarificació que aportà, té el greu inconvenient de deixar totalment al marge els fenòmens que no tenen lloc en solució aquosa. Així, per exemple, la reacció entre gasos HCl + NH3 →NH+4 + Cl- que dóna lloc a la formació de clorur amònic (compost cristal·lí ionitzat que és una veritable sal), és evidentment una neutralització, però no troba interpretació possible en la teoria.
La teoria de Brønsted i Lowry sobre els àcids. Teories posteriors
Una teoria més general, que engloba la d’Arrhenius com un cas particular, és la teoria de Brønsted i Lowry (1923), avui la més utilitzada, segons la qual és un àcid tota substància capaç de donar protons (ions H+), i base tota substància capaç d’acceptar-los. Esquemàticament, això pot resumir-se amb l’expressió: àcid = base + protó, i cada àcid tindrà, doncs, una base corresponent, que és anomenada la seva base conjugada (la qual deriva de l’àcid per pèrdua d’un protó), i, recíprocament, cada base tindrà el seu àcid corresponent, el seu àcid conjugat (que deriva de la base per addició d’un protó). Com més forta serà la tendència a cedir protons (o a acceptar-los), més gran serà la força d’un àcid (o d’una base). Per tant, la base conjugada d’un àcid fort serà una base feble, i la base conjugada d’un àcid feble serà una base forta. Així, l’ió Cl- és una base feble, ja que l’àcid HCl és un àcid fort; l’ió CH3 CO2- és una base forta, ja que l’àcid CH3COOH és un àcid feble.
L’àcid la molècula del qual pot cedir un sol protó és anomenat àcid monopròtic, i el que pot cedir-ne diversos, àcid polipròtic">. La definició de Brønsted i Lowry modificà radicalment el concepte de base (explicant el fet que molts composts que no donen ions OH- manifestin propietats bàsiques) i féu els conceptes d’àcid i de base (i de neutralització) independents del dissolvent aigua i independents de la càrrega elèctrica (poden ésser àcids i bases tant les substàncies neutres com els ions).
Així, per exemple, l’ió amoni NH+4, en l’amoníac líquid NH3, és un àcid, ja que cedeix fàcilment el seu protó. Perquè NH+4 manifesti les seves propietats àcides cal, però, la presència d’una base, ja que, en efecte, en la teoria de Brønsted i Lowry la definició d’àcid és acompanyada de la constatació del fet que el protó no existeix lliure (almenys en circumstàncies normals) i que, per tant, els àcids manifesten només llurs propietats quan hi ha una base present (un acceptador de protons) i les bases només quan hi ha un àcid present (un donador de protons). En conseqüència, les reaccions on intervenen àcids i bases (tant si es tracta de la dissociació en solució, de la neutralització o del desplaçament d’un àcid feble per un àcid fort o d’una base feble per una base forta) fan intervenir sempre l’equilibri entre dues parelles d’àcids i bases conjugats i totes són reductibles a la mateixa equació general d’equilibri:
HB1 + B2 ⇌ HB2 + B1
àcid 1 base 2 àcid 2 base 1
En molts casos, una mateixa substància pot actuar enfront de les bases com un àcid, i enfront dels àcids com una base. Aquestes substàncies són dites amfòteres. Tenen sempre propietats amfòteres les diverses bases conjugades dels àcids polipròtics que resulten de la cessió d’un nombre de protons inferior al màxim possible. Des d’un altre punt de vista té també propietats amfòteres l’aigua, la qual actua, en efecte, com una base respecte als àcids (el seu àcid conjugat és aleshores l’ió H3O+: HA + H2O ⇌ H3O+ + A- i com un àcid respecte a les bases (la seva base conjugada és aleshores l’ió OH-): B + H2O ⇌ HB+ + OH-.
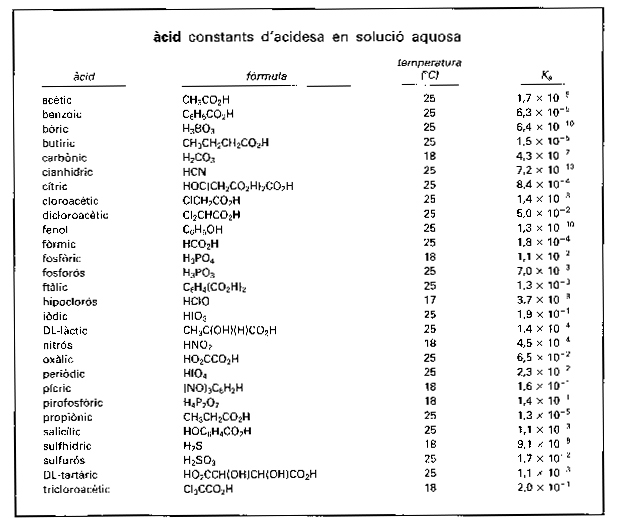
Els dissolvents que, com l’aigua, manifesten aquest doble comportament són anomenats amfipròtics. La força d’un àcid, és a dir, la seva acidesa, esdevé en la teoria de Brønsted i Lowry una cosa relativa, que en realitat només pot ésser expressada respecte a una base determinada. Així, per exemple, la força de l’àcid HA en solució aquosa (és a dir, respecte a la base H 2O) ve mesurada per la seva constant d’acidesa K A , que depèn de la constant d’equilibri K de la reacció HA + H2O ⇌ H3O+ + A-, però en un altre dissolvent amfipròtic S dependrà de l’equilibri de la reacció HA + S ⇌ HS+ + A-.
D’altra banda, les propietats àcides de les solucions seran, en solució aquosa, les de l’ió H3O +, i, en general, les de l’ió HS+. La dependència del dissolvent explica l’efecte anivellador de les forces dels àcids que aquest sovint exerceix. Per a tots els àcids que siguin considerablement més forts que S, la reacció anterior HA + S ⇌ HS+ + A- serà pràcticament completa i no podrà mesurar-se cap constant d’equilibri i, per tant, tots aquests àcids apareixeran com essent de força equivalent. Això és el que passa, per exemple, amb els àcids anomenats forts en solució aquosa. La situació varia, això no obstant, si hom agafa un dissolvent més acídic, i sovint és aleshores possible posar en evidència una diferència de forces. Així, per exemple, per als àcids nítric, clorhídric, sulfúric i perclòric, que són d’igual força en solució aquosa, l’estudi en altres dissolvents ha demostrat que tenen forces creixents per l’ordre indicat.
En resum, la teoria de Brønsted i Lowry, conservant totes les aportacions de la vella teoria d’Arrhenius, dóna una explicació unitària d’una sèrie de fenòmens anteriorment no correlacionats (especialment en solucions no aquoses) i permet d’establir sobre una base sòlida el concepte d’acidesa; és una eina de treball eficaç i constitueix una simplificació considerable per a l’estudi de la química. El concepte d’àcid queda lligat, en la teoria de Brønsted i Lowry, al protó. Això no és cap inconvenient si hom considera, d’una banda, la importància del protó i de l’element hidrogen en la química usual; d’altra banda, la significació que ha estat donada durant segles al mot àcid.
Aquest concepte és tanmateix encara susceptible d’una generalització més gran i, si hom abandona els motlles tradicionals, és possible d’establir correlacions noves entre fenòmens aparentment dissemblants. En efecte, sense allunyar-se gens dels criteris fenomenològics indicats al començament, Gilbert N. Lewis demostrà (teoria de Lewis), el 1923, que podia ésser donada una nova definició d’àcid, que engloba la de Brønsted i Lowry com un cas particular i que fa entrar en el quadre de la teoria dels àcids i bases una sèrie de fenòmens que en queden altrament al marge. Aquesta definició consisteix a dir que un àcid és una substància coordinativament insaturada, és a dir, capaç d’acceptar una parella d’electrons per a formar un enllaç covalent coordinat (i que una base és tota substància capaç de cedir-los). La neutralització és aleshores la formació d’aquest enllaç. De la definició resulta immediatament que tota base de Brønsted i Lowry és una base de Lewis. El protó isolat és evidentment un àcid de Lewis i perquè els àcids de Brønsted i Lowry puguin ésser considerats àcids de Lewis, n’hi ha prou amb admetre que el nou enllaç covalent coordinat (format pel protó cedit) es forma al mateix temps que té lloc la ruptura de l’antic (cosa que equival a dir que el protó no queda mai lliure enterament).
És a dir, un àcid de Brønsted i Lowry, dit també àcid protònic, és coordinativament insaturat (i per tant àcid de Lewis) a causa de la possibilitat de formació d’un enllaç hidrogen. L’interès de la teoria de Lewis consisteix en el fet que apareixen aleshores com a àcids no solament nombroses substàncies considerades neutres (tals com, per exemple, el triclorur o el trifluorur de bor), sinó àdhuc substàncies que eren considerades sals (per bé que no tenen sempre les propietats de les veritables sals), tals com, per exemple, el clorur d’alumini, el perclorat de plata, el clorur de zinc, el tetraclorur d’estany, etc. Totes les substàncies que poden actuar, per exemple, com a catalitzadors en la reacció de Friedel i Crafts són, de fet, àcids de Lewis.
La denominació d’àcid de Lewis és reservada sovint als àcids no protònics, establint així una distinció còmoda entre els àcids ordinaris i els que també han estat anomenats generalitzats. Els àcids de Lewis són, fenomenològicament, veritables àcids; en solució orgànica, actuen sobre molts indicadors i poden ésser valorats fàcilment per alcalimetria; donen composts de coordinació perfectament isolables amb nombroses bases; tenen activitat catalítica; donen lloc a reaccions de desplaçament i, en certes ocasions, poden àdhuc dissoldre els metalls. És evident en alguns casos (trifluorur de bor, per exemple) que són coordinativament insaturats. En altres, la insaturació coordinativa apareix solament si hom considera que la major part de metalls poden tenir més de vuit electrons en llurs capes electròniques de valència; en alguns casos, aquesta insaturació no existeix en l’estat normal de la molècula, representat per les fórmules electròniques corrents, però apareix en un estat excitat. Aquests àcids foren anomenats per Lewis àcids secundaris i l’exemple més típic és el del CO 2, que pot actuar com a àcid només en un estat excitat representable per la per la fórmula O = C+ - O-.
La reacció dels àcids secundaris requereix, doncs, una energia d’activació. Si és acceptada la definició de Lewis, hom dedueix immediatament que els adjectius àcid i bàsic són equivalents a electrofílic i nucleofílic i que els àcids són acceptors i les bases donadors d’electrons. La inversa, en canvi, no sempre és certa, perquè els termes esmentats no es restringeixen al cas de la covalència coordinativa. Per això, malgrat que tot sigui qüestió de definició i per tant de convenció, el terme àcid de Lewis és extensament utilitzat en la literatura química moderna. Quan hom parla, però, d’un àcid, sense més precisió, en principi cal entendre que es tracta d’un àcid de Brønsted i Lowry.
Un darrer concepte en la teoria dels àcids i bases, introduït per Pearson el 1963, és el d’àcids i bases durs i tous. No es tracta en aquest cas de l’extensió dels conceptes precedents, sinó d’una classificació que tracta d’explicar i preveure les diferències de reactivitat dels àcids i bases, en el sentit general de Lewis, i les diferències d’estabilitat dels composts de coordinació suseptibles ésser formats. Per a Pearson, tota molècula, carregada elèctricament o no, pot ésser considerada com el “complex” que resulta de l’associació d’un àcid i d’una base, reals o hipotètics. Els àcids aleshores es classifiquen en àcids durs i en àcids tous segons que llurs orbitals frontera vacants siguin d’un nivell energètic elevat o baix, respectivament (igualment, les bases es classifiquen en “dures” i “toves” segons que llurs orbitals frontera ocupats siguin d’un nivell energètic baix o elevat, respectivament). La regla establerta per Pearson és que els àcids durs s’uneixen més fàcilment a les bases dures, i els tous a les toves, que no pas a la inversa, i que els “complexos” formats són més estables entre entitats del mateix tipus que entre entitats de tipus diferent. Malgrat que no tot queda perfectament explicat, la noció d’àcids i bases “durs” i “tous” permet d’interpretar nombrosos fets aparentment isolats i sense correlació entre ells, tant en química inorgànica com en química orgànica.