L’element natural és una barreja dels núclids 35 (75,4%) i 37 (24,6%); hom li coneix set isòtops artificials: 32,33,34,36,38,39 i 40; és un gas diatòmic de color verd, d’on li ve el nom (del grec χλωρόϚ, ‘groc verdós’). Johann Rudolph Glauber (1646) en descriví la preparació, i Joseph Priestley (1772) fou el primer a obtenir-ne d’anhidre; pocs anys després (1774), Karl Wilhem Schelee l’obtingué per oxidació de l’àcid clorhídric. L’escorça terrestre en conté un 0,2%, i l’aigua de les mars i dels oceans, una mitjana de 18,2 g/l d’ió clor, és a dir, 0,513 ions-gram/l, que corresponen a una proporció de 2,5% de clorur de sodi. Existeix en estat natural en forma de clorurs cristal·litzats en nombroses espècies minerals, que constitueixen jaciments d’importància variable; les més conegudes són: clorur de sodi, sal gemma o halita (Na+Cl-), la silvita (K+Cl-), la silvinita (Na+Cl-, K+Cl-) i la carnal·lita (Mg2++Cl-, K+Cl-, 6H2O), totes activament explotades.
D’olor forta i sufocant, el clor és un tòxic actiu que provoca la mort en pocs minuts si l’aire respirat en conté més de 2,5 mg/l; ha estat el primer gas asfixiant emprat durant la Primera Guerra Mundial. Fàcil de liquidar, hom el transporta en estat líquid dins tubs d’acer a una pressió de 6,5 kg/cm2 i a una temperatura de 20°C. És bastant soluble en l’aigua. El fet de posseir set electrons perifèrics amb un potencial d’ionització considerable fa que sigui molt difícil d’extreure’n cap; el clor dona dos tipus d’enllaç: l’enllaç covalent simple, amb ell mateix, posant en comú un parell d’electrons (
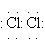
), i l’enllaç iònic, quan es combina amb un àtom feblement electronegatiu i dona l’anió Cl- (
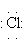
). El potencial d’oxidació, que descriu la tendència relativa de la reacció d’elèctrode 2Cl- →Cl2 + 2 e-, mostra el feble poder reductor de l’ió Cl-; la possibilitat de la reacció contrària Cl2 + 2 e-→2Cl-, indicada pel mateix potencial canviat de signe, palesa la gran tendència del clor a captar electrons i deixa preveure que és un oxidant fort i un element molt electronegatiu. El seu grau d’oxidació normal és -1 (ió Cl-), però hom li coneix també els estats d’oxidació corresponents als graus +1, +3, +4, +5, i +7.
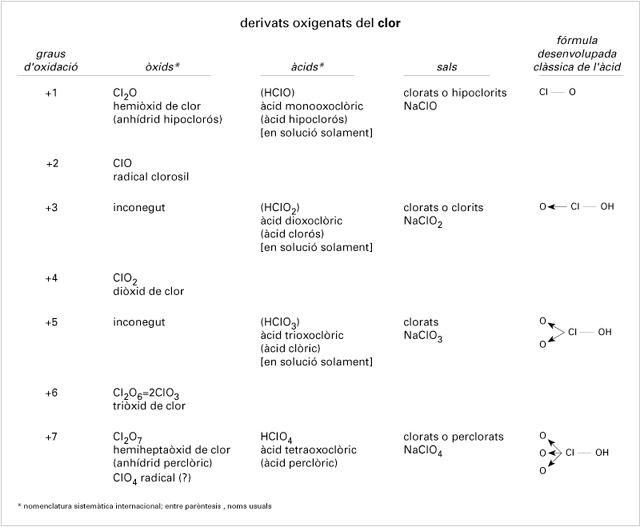
Derivats oxigenats del clor
El clor és un cos molt actiu, que es combina directament amb tots els elements, llevat dels gasos rars, de l’oxigen, del nitrogen i del carboni. El clor crema en el si de l’hidrogen segons la reacció 1/2 Cl2 + 1/2 HF → HCl + 92 kJ; tots dos gasos poden restar indefinidament barrejats en l’obscuritat, però un raig de sol o l’esclat de la combustió del magnesi provoquen la reacció fotoquímica Cl2 + hν → 2Cl; la reacció amb l’hidrogen dona Cl + H2 → HCl + H + 1 kcal, i l’àtom d’hidrogen obtingut reacciona, al seu torn, sobre una molècula de clor: H + Cl2 → HCl + Cl + 180 kJ; i així successivament. L’elevació de temperatura produeix l’acceleració del fenomen: és un cas simple de reacció en cadena no ramificada. El clor ataca tots els metalls, sovint amb incandescència, i la presència de vapor d’aigua intensifica considerablement la reacció. Quan el metall posseeix diversos graus d’oxidació, la presència d’un excés de clor condueix sempre al clorur de grau superior. El clor ataca també els elements no metàl·lics; els clorurs corresponents són tots volàtils a baixa temperatura i, en no poder formar una capa de protecció, la reacció és sovint molt viva. Els composts hidrogenats i metàl·lics no oxigenats, menys el fluorur d’hidrogen (FH), són tots destruïts completament; els hidrocarburs s’inflamen, sovint espontàniament, dins una atmosfera de clor i donen una reacció amb dipòsit de carboni; sota condicions diferents hom també observa reaccions de fixació del clor sobre els enllaços acetilènic (CH ≡;CH+Cl2→CHCl=CHCl) i etilènic (CH2=CH2+Cl2 →CH2Cl-CH2Cl) o de substitució: CH4+Cl2 →CH3Cl (i també CH2Cl2, CH3Cl i CCl4). L’acció del clor sobre els composts hidrogenats o metàl·lics que contenen oxigen condueix en general a un equilibri amb formació d’un clorur o, a vegades, d’un oxiclorur; hom obté el clorur quan es tracta de l’òxid corresponent al grau d’oxidació més estable del metall: 2 Fe2 O3 + 6Cl2 ⇌4(Fe3+++ Cl-) + 3O2; en els altres casos l’oxigen no és desplaçat: SO2 + Cl2 →SO2Cl2 (clorur de sulfonil). El clor gasós es combina amb el vapor d’aigua segona la reacció H2O + Cl2 →2HCl + 1/2 O2 - 59 kJ; amb l’aigua dona l’aigua de clor.
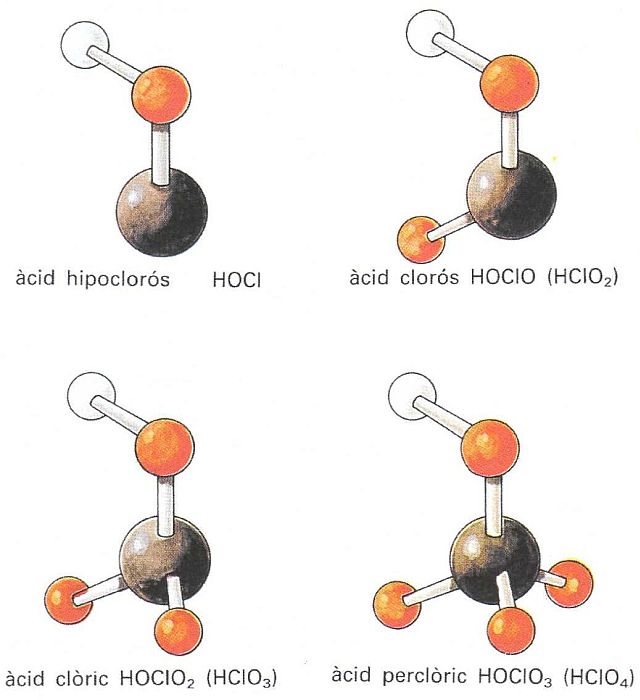
Estructures suposades dels oxiàcids del clor
En presència d’hidròxid de sodi (sosa càustica) la reacció a total: Cl2 + 2(Na+HO-) →Na+Cl- + Na+ClO + H2O, i hom n’obté el lleixiu, utilitzat com a descolorant i bactericida, propietats degudes al poder oxidant de l’hipoclorit de sodi que es descompon amb una gran facilitat: Na+ClO- →Na+Cl- + 1/2 O2, i a la tensió corresponent a la reacció Cl2 + 2e- →2Cl- (1,36 V) del clor en solució normal de clorur saturada de clor.
El clor s’usa com a descolorant, en el blanqueig de matèries vegetals (pasta de paper, teixits, etc.) i per a la fabricació de clorurs descolorants; hom l’empra com a bactericida, per tal com es combina amb els grups α-amínics de les proteïnes; l’aigua de molts municipis és purificada amb clor; també serveix per a la fabricació del clorur d’hidrogen i de molts clorurs metàl·lics. La indústria química en consumeix una proporció com més va més important per a l’obtenció de productes acabats, d’utilització immediata, o per a fabricar cossos intermediaris, indispensables per a fer la síntesi de productes de gran consum: tetraclorur de carboni (CCl4), solvent líquid d’extintors; clorur de sofre (S2Cl2), agent de cloruració, usat en la vulcanització del cautxú; triclorur de metà (cloroform: CHCl3), solvent i anestèsic general; clorur de metà, refrigerant, anestèsic local; diclorodifluorometà (CCl2F2), líquid refrigerant; clorur d’età (C2H5Cl), per a la fabricació del plom tetraetil, Pb(C2H5)4; tetraclorur d’età (CHCl2-CHCl2), solvent de gran utilització; DDT o diclorodifeniltricloroetà, (ClC6H4)2CHCl1, l’insecticida tan difós; clorobenzè (C6H5Cl), que permet la fabricació del fenol; etc.
