Fou aïllat per J.G. Gahn el 1774. De dotze isòtops radioactius coneguts, només n’hi ha un d’estable. El manganès és de color gris amb reflexos vermellosos, i es presenta en tres varietats al·lotròpiques: la forma α, cúbica, d’una densitat 7,44 i estable per sota de 742°C, la forma β, també cúbica i estable en l’interval 742-1 191°C, i la forma γ, tetragonal, del manganès electrolític, que és estable per sobre de 1.190°C.
El manganès és molt difós a la natura, i és indispensable per a la vida; els principals minerals són l’hausmannita (Mn3O4), la pirolusita o manganesa (MnO2), la braunita (Mn2O3) i la manganita (MnOOH). En forma de nòduls polimetàl·lics manganífers es troba en determinades zones del Pacífic. En la indústria hom l’obté per reducció dels òxids o per aluminotèrmia:
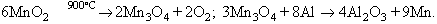
El manganès és un element reactiu de comportament semblant al del ferro. Presenta totes les valències d’1 fins fins a 7; els òxids de valència 2 i 3 són bàsics, els de valència 4, 6 i 7 formen els anhídrids àcids, i les valències 1 i 5 representen composts complexos. Descompon l’aigua lentament en fred; l’àcid sulfúric l’ataca a una temperatura alta, segons la reacció Mn + 2H2SO4 →MnSO4 + SO2 + 2H2O. Molts àcids diluïts el dissolen, amb formació de sals manganoses. Alguns metalls (Al, Mg, Zn) el desplacen de les seves sals, però el metall alliberat s’oxida en contacte amb l’aigua. Es combina amb els halògens i forma composts del tipus MnX2, MnX3, MnX4; les sals de la forma MnX3 són conegudes només en estat sòlid, i en dissolució s’hidrolitzen i produeixen diòxid de manganès. També es combina amb el sofre i el fòsfor, i forma una amalgama amb el mercuri, així com diversos aliatges, alguns d’una extraordinària importància industrial. El dosatge gravimètric del manganès té lloc per precipitació del fosfat doble d’amoni i manganès (MnNH4PO4 · H2O), que hom calcina a 600°C i pesa en forma de pirofosfat (Mn2P2O7). El manganès és emprat sobretot en la manufactura d’aliatges (ferromanganès, cupromanganès).
La importància econòmica del manganès prové essencialment de la seva utilització en els processos siderúrgics, que n’absorbeixen més d’un 95% de la producció. El progrés tecnològic, però, ha fet disminuir el llindar de rendibilitat, pel que fa a contingut de manganès, que hom calculava en un 35% de metall, a les explotacions mineres. D’altra banda, el manganès no ocupa, en el mercat mundial de primeres matèries, un lloc anàleg al d’altres metalls no ferris: tant la producció com el consum tenen un alt grau de concentració, fins al punt que una bona part de les explotacions són finançades pels usuaris. Per això el preu del manganès no és sotmès a les fluctuacions que caracteritzen el d’altres metalls, com el coure, el zinc, el plom i l’estany. La demanda mundial de manganès ha experimentat un fort increment els darrers decennis: dels 2,5 milions de t el 1938 superà els 7,5 el 1970 i els 9,5 el 1983. L’URSS n’és el primer productor mundial, seguit de Sud-àfrica, el Brasil, el Gabon, Austràlia, l’Índia i la Xina. Aquests set països absorbeixen un 80% de la producció mundial. Uns altres països productors són Mèxic, Ghana, el Marroc i el Japó.