Fou descobert, independentment, per J. Priestley (1774) i K.W. Scheele (1773). El 1775 Antoine Laurent Lavoisier li donà el nom definitiu i basà en ell la seva teoria de la combustió i l’oxidació.
L’oxigen es troba a la natura en estat lliure, com a O2 i, en molt més petita proporció, com a O i O3 (ozó); constitueix el 23% de la massa de l’atmosfera, i combinat en un gran nombre de composts, els més importants dels quals són l’aigua, la sorra (SiO2) i els silicats, constitueix el 46,5% de la massa de l’escorça terrestre. Existeix en forma de tres isòtops naturals estables: 16O (99,759%), 17O (0,0374%) i 18O (0,2039%). L’isòtop 16O fou emprat com a base per a l’establiment dels pesos atòmics dels altres elements fins el 1961, que la IUPAC adoptà el 12C com a nova base. Presenta valència -2 i forma molècules diatòmiques molt estables (O2 →2O - 118 kcal), paramagnètiques en tots tres estats, d’acord amb les prediccions de la teoria de l’enllaç dels orbitals moleculars. És, després del fluor, l’element més electronegatiu. Es coneixen tres formes d’oxigen a la natura: oxigen molecular (O2), ozó (O3) i O4. El primer és la forma més estable, un gas incolor, inodor i insípid que es troba en altes concentracions a l’atmosfera. L’ozó es forma a l’atmosfera per reaccions fotoquímiques d’oxigen molecular provocades per la radiació ultraviolada. La forma O4 és molt inestable i es trenca amb facilitat. La preparació industrial de l’oxigen té lloc, principalment, per destil·lació fraccionada de l’aire líquid i, en una escala molt més petita, per electròlisi de l’aigua. La distribució comercial és feta principalment en tubs d’acer amb una pressió de 150-200 atm. Hom l’obté fàcilment al laboratori escalfant clorat potàssic en presència de diòxid de manganès, d’acord amb l’equació
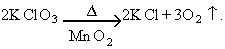
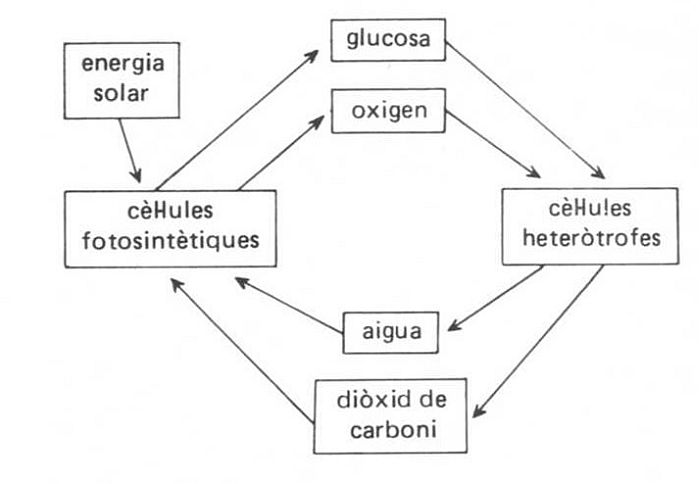
L’oxigen té una elevada reactivitat i forma composts binaris (anomenats òxids, excepte en el cas del fluor) amb tots els elements, llevat amb els gasos nobles de nombre atòmic baix. La majoria dels elements reaccionen directament amb l’oxigen, molts d’ells violentament, i solament els òxids d’halògens, els gasos nobles i alguns metalls nobles són obtinguts per mètodes indirectes. Pot també reaccionar amb un gran nombre de substàncies compostes, en reaccions dites d’oxidació. A temperatura ambient, la molècula d’oxigen és poc reactiva, però actua enfront dels reductors inorgànics forts, com el sulfat de ferro (II), i d’un cert nombre de substàncies orgàniques en reaccions d’oxidació autocatalítica (o autooxidació), responsables de l’envelliment d’una gran varietat de materials. També transcorren en aquesta temperatura les oxidacions biològiques, que proporcionen energia als éssers vius respiració. A temperatures més elevades, reacciona directament amb la majoria d’elements i amb una gran varietat de composts orgànics en reaccions de combustió, d’una gran importància per a la producció d’energia. En determinades condicions de pressió i temperatura es pot aconseguir oxigen líquid i oxigen sòlid; totes dues formes són de color blau. L’oxigen pot passar de l’estat líquid a un estat sòlid metàl·lic en condicions de temperatures i pressions molt elevades, per sobre de 4.500 K i 100 atm.
Les aplicacions industrials més importants de l’oxigen són les soldadures oxhídrica i oxiacetilènica bufador, basades, respectivament, en les reaccions H2 + 1/2O2 →H2O i CH≡CH + 5/2O →2CO2 + H2, fortament exotèrmiques; l’obtenció del gas de síntesi mitjançant l’oxidació parcial del metà, d’acord amb l’equació CH4 + 1/2O2 →CO + 2H2 i la preparació del peròxid sòdic, i el seu ús, en estat líquid, com a comburent per a coets.
Propietats físiques de l’oxigen
| nombre atòmic | 8 |
| pes atòmic | 15,999 |
| estructura electrònica | [He] 2s22p4 |
| estats d’oxidació | -2 |
| densitat | 1,14 g/ml |
| punt de fusió | -218,4ºC |
| punt d’ebullició | -182,96ºC |
| radi iònic (O-2) | 1,32 Å |
| potencial d’ionització, en eV | I: 13,618 |
| II: 35,116 | |
| temperatura crítica | -118,4ºC |
| pressió crítica | 50,15 atm |