Totes les altres substàncies existents en la natura o produïdes artificialment són formades per proporcions definides dels elements existents. Per oposició a les substàncies compostes o combinacions, hom els anomena també substàncies elementals o cossos simples. El 1661, R. Boyle, analitzant amb sentit crític el resultat del treball dels alquimistes, formulà el concepte d’element fent abstracció de totes les estructures metafísiques dels alquimistes i postulà que només les substàncies tangibles i ponderables podien ésser considerades com a elements, i així considerà tots els metalls del seu temps.
De fet, però, la definició científica d’element fou donada a la segona meitat del segle XVIII per A.L. Lavoisier basant-se en les idees de R. Boyle; en el seu Traité élémentaire de chimie (1789) figuren una trentena d’elements, entre els quals la llum i la calor, eliminades per J.J. Berzelius en el seu Lehrbuch der Chemie (1818), on esmenta una cinquantena d’elements.
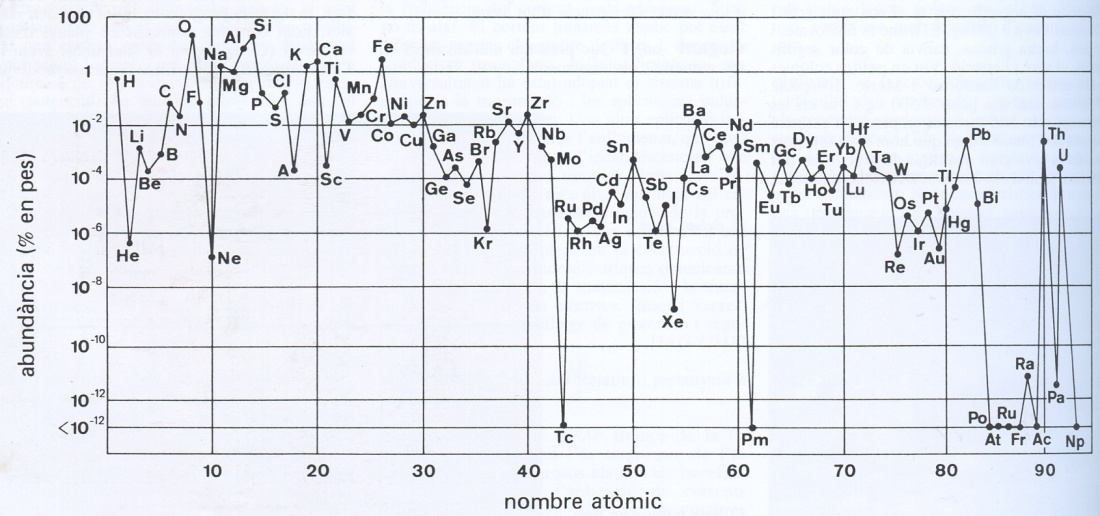
Gràfic de l’abundància (% es pes) dels elements de l’escorça terrestre en funció del nombre atòmic; confirmació de la regla de Harkins, segons la qual els elements de nombre atòmic parell són, en general, més abundants que els de nombre atòmic imparell
En el decurs del temps, el concepte d’element químic es va lligant, com més va més, al d’espècie atòmica (àtom) caracteritzada per una massa atòmica determinada, que representa l’única propietat atòmica aleshores coneguda. Els darrers avenços de la física a partir de la segona meitat del segle XIX (descobriment dels raigs X, radioactivitat, electró, transmutació artificial dels elements) permeten d’explicar les diferències físiques i químiques existents entre ells, amb la determinació que la característica més important d’un element químic és la càrrega del nucli dels àtoms que el componen, la qual càrrega determina el nombre atòmic i fixa el lloc de l’element en la taula periòdica i l’estructura electrònica dels àtoms, de la qual depenen les propietats dels elements.
Actualment hom defineix els elements químics com a constituïts per àtoms amb la mateixa càrrega nuclear, és a dir, que tenen els mateixos protons en el nucli i un nombre d’electrons extranuclears, distribuïts en els distints orbitals atòmics, igual als protons del nucli. En la taula periòdica, les files horitzontals són anomenades períodes, mentre que les columnes reben el nom de grups. Els àtoms dels elements d’un mateix grup presenten una configuració electrònica similar, la qual cosa es reflecteix en una semblança de propietats físiques i químiques. En algunes taules, els grups són numerats amb xifres romanes (IA i IIA per a les columnes 1 i 2, i de IIIA a VIIIA per a les columnes 13 a 18; i de IIIB a VIIIB per a les columnes 3 a 10, i de IB i IIB per a les columnes 11 i 12). Des d’un punt de vista morfològic, i separant de bell antuvi el grup dels gasos nobles (columna 18), els elements del qual presenten propietats ben diferenciades, hom pot classificar d’una manera aproximada la resta d’elements que componen la taula periòdica en metalls o elements metàl·lics i no-metalls o elements no metàl·lics, basant-se en el fet que el caràcter metàl·lic es troba localitzat en la regió inferior esquerra de la taula i el no metàl·lic a la superior dreta. El que resta més confús és la diferenciació clara entre una regió i l’altra, bé que hom accepta que els elements que la marquen són el bor, el silici i el germani, l’arsènic i l’antimoni, i el tel·luri i el poloni, anomenats sovint metal·loides, a la dreta dels quals hom localitza els no-metalls. Les tres quartes parts dels elements químics són metalls, bé que hom pot fer una ulterior classificació en metalls dels grups principals, metalls de transició i metalls de transició interna (actínid, lantànid). Hom designa els elements per llur símbol.
Els mètodes que han conduït al descobriment i, després, a l’isolament dels nous elements químics han evolucionat profundament; als mètodes tradicionals de caire quimicoanalític s’ajuntava després del 1859, gràcies a G. Kirchhoff i R. Bunsen, l’anàlisi espectral, que permeté, per l’estudi dels espectres dels estels, de fixar la unitat de constitució de l’Univers. Després, l’anàlisi dels espectres dels raigs X, juntament amb la llei de Moseley, feu possible la determinació del nombre atòmic dels elements. L’anàlisi dels aeròlits i l’anàlisi espectral dels estels no han permès d’identificar elements inconeguts a la Terra, però han demostrat que la seva composició isotòpica pot variar notablement en funció de les condicions en què es desenvolupen actualment els processos de formació dels elements químics (fusió de partícules nuclears simples a temperatures de l’ordre de 108°C) en els estels.
El primer element obtingut artificialment fou el tecneci, de nombre atòmic 43, sintetitzat el 1937. D’aquesta forma, s’omplia un dels buits existents en la taula periòdica. El primer element transurànid (de nombre atòmic superior a 92) fou el neptuni, obtingut el 1940. Fins al 1961, i gràcies a l’ús d’acceleradors de partícules com el ciclotró, s’arribà a l’element 103, el lawrenci. El següent, l’unnilquadi no s’obtingué fins el 1969 i l’unnilpenti (número 105), el 1970. Respecte a aquests dos, els científics russos han presentat demandes sobre la paternitat del descobriment. Segons la versió que han presentat, l’element 104, que anomenaren kurtxatovi, fou obtingut a Dubna el 1964, i el 105, que anomenaren nielsbohri, s’hauria sintetitzat al mateix lloc el 1970. També asseguren haver obtingut els elements 106 (l’any 1974) i el 107 (dos anys més tard).
L’obtenció de nous elements és complexa, perquè la vida mitjana disminueix amb el nombre atòmic. Així, els elements 108 i 109 ja tenen una vida mitjana de només 1,8 i 3,4 mil·lisegons, respectivament. Els elements 93, 95, 99 i 100 foren obtinguts bombardejant un element de sortida amb neutrons. El nucli absorbeix un neutró i això dona un isòtop d’un element ja conegut. Aquest isòtop és inestable i el neutró es desintegra tot produint un protó. Això fa augmentar el nombre atòmic i dona un nou element. Un altre mètode consisteix a bombardejar un element de sortida amb nuclis d’un altre element (d’hidrogen, de deuteri, d’heli, de carboni, etc). Els dos nuclis es fusionen i en formen un de nou en un estat excitat (en un estat energètic superior a l’habitual). Aquesta energia es dissipa i el nou element s’estabilitza. Les quantitats obtingudes són molt petites i la vida mitjana és tan curta que la detecció és complexa. Fins l’element 101, la detecció es podia fer preparant sals del nou element i separant els ions amb resines de bescanvi iònic. Amb els darrers s’ha fet estudiant-ne les traces de la desintegració radioactiva. Tot i la vida mitjana tan curta dels nous elements, hom pensa que hi ha unes ‘illes d’estabilitat’, que correspondrien a nuclis amb un nombre determinat de protons i neutrons. Així, R. Nix i els seus col·laboradors calcularen, el 1972, que l’element 114 amb 184 neutrons seria estable. El 1989, el polonès Z. Patyk, de l’Institut de Recerca Nuclear de Varsòvia, proposà que el nucli amb 182 o 184 neutrons era el més estable, amb una regió d’elements amb vida mitjana més llarga a partir de l’element 110. El nucli amb 112 protons i 184 neutrons seria esfèric i molt estable. Un gràfic que mostra l’estabilitat dels elements en funció del nombre de protons i de neutrons indica que, teòricament, l’element 114 representaria una anomenada illa d’estabilitat.
Hi ha tres laboratoris en el món que sintetitzen elements nous: el Lawrence Laboratory dels Estats Units, l’Institut de Recerca Nuclear de Dubna, a Rússia, i l’Institut d’Investigació d’Ions Pesants (GSI) de Darmstadt, Alemanya. Durant l’època de la guerra freda, els descobriments dels equips soviètics no eren acceptats pels nord-americans, i viceversa. Així, es donà la situació que un mateix element químic tenia un nom diferent en cada país. La situació es complicà pel fet que l’organisme que té competències de nomenclatura química, la IUPAC, no acceptà aquests noms sinó que proposà una nova nomenclatura sistemàtica basada en el nombre atòmic dels elements en llatí. Aquesta nomenclatura tampoc no fou acceptada, amb la qual cosa alguns elements tingueren tres noms. Per exemple, l’element 104 fou anomenat unnilquadi per la IUPAC, kurtxatovi pels russos i rutherfordi pels nord-americans. Fins al cap de gairebé dues dècades no s’arribà a un acord sobre l’ordre dels descobriments.
Per als darrers elements químics, la major part dels noms proposats deriven dels cognoms de científics relacionats amb la recerca nuclear (Rutherford, Bohr, Meitner) o localitzacions geogràfiques on són emplaçats els laboratoris (Dubna, Darmstadt, Hesse). La recerca de nous elements químics ha deixat d’ésser una qüestió purament química i s’hi ha incorporat la física nuclear. En efecte, en la natura no es troben elements per sobre del nombre atòmic (Z) 92, el de l’urani; els elements que hi estan per sobre són radioactius, com l’urani, però tenen vides mitjanes relativament curtes. Això fa que qualsevol quantitat sintetitzada de forma natural s’hagi desintegrat fa molt de temps. S'observa, a més, que la inestabilitat dels nuclis augmenta amb el nombre atòmic, encara que no en progressió lineal. Així, el californi (Z=98) té isòtops amb vida mitjana superior als 250 anys, els de mendelevi (Z=101) no arriben a 52 dies i els de bohri (Z=107) no passen d’un segon. Això té una doble implicació: els elements amb Z grans són molt difícils de sintetitzar i en ésser tan inestables són molt difícils de detectar. La síntesi requereix amplis càlculs sobre el tipus d’àtoms projectil que es fan servir per a bombardejar; s’ha de calcular la secció eficaç i les condicions més adients per tal que el nombre de xocs sigui el més elevat possible. Tot i això, cal repetir moltes vegades els experiments i se sol aconseguir un nombre molt petit d’àtoms de l’element que es busca; per exemple, de l’element 114 tan sols se'n van obtenir quatre àtoms.
Cada pocs anys es descobreixen nous elements: els elements 110 i 111 foren descoberts el 1994; el 112, el 1996; el 114, el 1998, i el 116, el 2000. Malgrat la gran precisió dels detectors emprats, de vegades s’anuncia un descobriment fals, com el que feren el 1998 els científics del Lawrence Laboratory, que proclamaren la síntesi de l’element 118 (ununocti). Després de la revisió de l’experiment, la IUPAC acceptà el descobriment a tràmit, però cap nou element no és totalment acceptat fins que l’experiment no és reproduït per un altre grup investigador. A causa de la impossibilitat de reproducció, la IUPAC donà marxa enrere pel que fa a l’acceptació de l’ununocti. D’altra banda, s’ha comprovat que les prediccions teòriques sobre l’estabilitat del nucli no són gaire acurades; si bé és cert que sembla haver-hi una illa d’estabilitat al voltant de l’element 112, aquest no és estable. El seu isòtop més estable es desintegra en 11 minuts, mentre que el més estable del seu predecessor, el roentgeni, només arriba a uns quants segons i els de l’ununtri són encara més inestables. Les dificultats de sintetitzar els nous elements i de detectar-ne les petites quantitats que se n'obtenen fan molt complexa la tasca de síntesi, però és possible que en els propers anys la taula periòdica s’ampliï.
| Nom | Símbol químic | Nombre atòmic | Grup | Massa atòmica | Densitat a 20°C (g/cm3) | Punt de fusió (°C) | Punt d'ebullició (°C) | Descobridor | Descobriment |
| Actini | Ac | 89 | 3 | 227,0278 | 10,07 | 1047 | 3197 | André Louis Debierne | 1899 |
| Alumini | Al | 13 | 13 | 26,981539 | 2,7 | 660,5 | 2467 | Hans Christian Ørsted | 1825 |
| Americi | Am | 95 | 3 | 243,0614 | 13,67 | 994 | 2607 | Glenn T. Seaborg | 1944 |
| Antimoni | Sb | 51 | 15 | 121,75 | 6,69 | 630,7 | 1750 | desconegut | prehistòric |
| Argent | Ag | 47 | 11 | 107,8682 | 10,49 | 961,9 | 2212 | desconegut | prehistòric |
| Argó | Ar | 18 | 18 | 39,948 | 0,001 66 | -189,4 | -185,9 | William Ramsay i Lord Rayleigh | 1894 |
| Arsènic | As | 33 | 15 | 74,92159 | 5,72 | 613 | 613 | Albert Magne | ca. 1250 |
| Àstat | At | 85 | 17 | 209,9871 | 302 | 337 | Corson i MacKenzie | 1940 | |
| Bari | Ba | 56 | 2 | 137,327 | 3,65 | 725 | 1640 | Humphry Davy | 1808 |
| Beril·li | Be | 4 | 2 | 9,012182 | 1,85 | 1278 | 2970 | Louis Nicolas Vauquelin | 1797 |
| Berkeli | Bk | 97 | 3 | 247,0703 | 13,25 | 986 | Glenn T. Seaborg | 1949 | |
| Bismut | Bi | 83 | 15 | 208,98037 | 9,8 | 271,4 | 1560 | Georg Agricola | 1540 |
| Bohri | Bh | 107 | 7 | 262,1229 | Oganessian | 1976 | |||
| Bor | B | 5 | 13 | 10,811 | 2,46 | 2300 | 2550 | Humprhy Davy i Louis Joseph Gay-Lussac | 1808 |
| Brom | Br | 35 | 17 | 79,904 | 3,14 | -7,3 | 58,8 | Antoine Jérôme Balard | 1826 |
| Cadmi | Cd | 48 | 12 | 112,411 | 8,64 | 321 | 765 | Friedrich Stromeyer i Hermann | 1817 |
| Calci | Ca | 20 | 2 | 40,078 | 1,54 | 839 | 1487 | Humphry Davy | 1808 |
| Californi | Cf | 98 | 3 | 251,0796 | 15,1 | 900 | Glenn T. Seaborg | 1950 | |
| Carboni | C | 6 | 14 | 12,011 | 3,51 | 3550 | 4827 | desconegut | prehistòric |
| Ceri | Ce | 58 | 3 | 140,115 | 6,77 | 798 | 3257 | von Hisinger i Berzelius | 1803 |
| Cesi | Cs | 55 | 1 | 132,90543 | 1,9 | 28,4 | 690 | Gustav R. Kirchhoff i Robert Wilhelm Bunsen | 1860 |
| Clor | Cl | 17 | 17 | 35,4527 | 0,002 95 | -34,6 | -101 | Carl Wilhelm Scheele | 1774 |
| Cobalt | Co | 27 | 9 | 58,9332 | 8,89 | 1495 | 2870 | Brandt | 1735 |
| Copernici | Cn | 112 | 12 | 277 | Gesellschaft für Schwerionenforschung | 1996 | |||
| Coure | Cu | 29 | 11 | 63,546 | 8,92 | 1083,5 | 2595 | desconegut | prehistòric |
| Criptó | Kr | 36 | 18 | 83,8 | 0,003 48 | -156,6 | -152,3 | William Ramsay i Morris Travers | 1898 |
| Crom | Cr | 24 | 6 | 51,9961 | 7,14 | 1857 | 2482 | Louis Nicolas Vauquelin | 1797 |
| Curi | Cm | 96 | 3 | 247,0703 | 13,51 | 1340 | Glenn T. Seaborg | 1944 | |
| Darmstadti | Ds | 110 | 10 | 269 | Gesellschaft für Schwerionenforschung | 1994 | |||
| Disprosi | Dy | 66 | 3 | 162,5 | 8,56 | 1409 | 2335 | Paul Émile Lecoq de Boisbaudran | 1886 |
| Dubni | Db | 105 | 5 | 262,1138 | Flerow oder Ghiorso | 1967/70 | |||
| Einsteini | Es | 99 | 3 | 252,0829 | 860 | Glenn T. Seaborg | 1952 | ||
| Erbi | Er | 68 | 3 | 167,26 | 9,05 | 1522 | 2510 | Mosander | 1842 |
| Escandi | Sc | 21 | 3 | 44,95591 | 2,99 | 1539 | 2832 | Lars Fredrik Nilson | 1879 |
| Estany | Sn | 50 | 14 | 118,71 | 7,29 | 232 | 2270 | desconegut | prehistòric |
| Estronci | Sr | 38 | 2 | 87,62 | 2,63 | 769 | 1384 | Crawford | 1790 |
| Europi | Eu | 63 | 3 | 151,965 | 5,25 | 822 | 1597 | Demaçay | 1901 |
| Fermi | Fm | 100 | 3 | 257,0951 | Glenn T. Seaborg | 1952 | |||
| Ferro | Fe | 26 | 8 | 55,847 | 7,87 | 1535 | 2750 | desconegut | prehistòric |
| Flerovi | Fl | 114 | 14 | ||||||
| Fluor | F | 9 | 17 | 18,9984032 | 0,001 58 | -219,6 | -188,1 | Henri Moissan | 1886 |
| Fòsfor | P | 15 | 15 | 30,973762 | 1,82 | 44 (P4) | 280 (P4) | Hennig Brand | 1669 |
| Franci | Fr | 87 | 1 | 223,0197 | 27 | 677 | Perey | 1939 | |
| Gadolini | Gd | 64 | 3 | 157,25 | 7,89 | 1311 | 3233 | de Marignac | 1880 |
| Gal·li | Ga | 31 | 13 | 69,723 | 5,91 | 29,8 | 2403 | Paul Émile Lecoq de Boisbaudran | 1875 |
| Germani | Ge | 32 | 14 | 72,61 | 5,32 | 937,4 | 2830 | Clemens Alexander Winkler | 1886 |
| Hafni | Hf | 72 | 4 | 178,49 | 13,31 | 2150 | 5400 | Coster i vón Hevesy | 1923 |
| Hassi | Hs | 108 | 8 | 265 | Gesellschaft für Schwerionenforschung | 1984 | |||
| Heli | He | 2 | 18 | 4,002602 | 0,000 17 | -272,2 | -268,9 | William Ramsay | 1895 |
| Hidrogen | H | 1 | 1 | 1,00794 | 0,000 084 | -259,1 | -252,9 | Henry Cavendish | 1766 |
| Holmi | Ho | 67 | 3 | 164,93032 | 8,78 | 1470 | 2720 | Soret i Per Teodor Cleve | 1878 |
| Indi | In | 49 | 13 | 114,82 | 7,31 | 156,2 | 2080 | Ferdinand Reich i Hieronymus Theodor Richter | 1863 |
| Iode | I | 53 | 17 | 126,90447 | 4,94 | 113,5 | 184,4 | Bernard Courtois | 1811 |
| Iridi | Ir | 77 | 9 | 192,22 | 22,65 | 2410 | 4130 | Tenant i andere | 1803 |
| Iterbi | Yb | 70 | 3 | 173,04 | 6,97 | 824 | 1193 | de Marignac | 1878 |
| Itri | Y | 39 | 3 | 88,90585 | 4,47 | 1523 | 3337 | Gadolin | 1794 |
| Lantani | La | 57 | 3 | 138,9055 | 6,16 | 920 | 3454 | Mosander | 1839 |
| Lawrenci | Lr | 103 | 3 | 260,1053 | Ghiorso | 1961 | |||
| Liti | Li | 3 | 1 | 6,941 | 0,53 | 180,5 | 1317 | Johan August Arfwedson | 1817 |
| Livermori | Lv | 116 | 16 | ||||||
| Luteci | Lu | 71 | 3 | 174,967 | 9,84 | 1656 | 3315 | Georges Urbain | 1907 |
| Magnesi | Mg | 12 | 2 | 24,305 | 1,74 | 648,8 | 1107 | Black | 1755 |
| Manganès | Mn | 25 | 7 | 54,93805 | 7,44 | 1244 | 2097 | Gahn | 1774 |
| Meitneri | Mt | 109 | 9 | 266 | Gesellschaft für Schwerionenforschung | 1982 | |||
| Mendelevi | Md | 101 | 3 | 258,0986 | Glenn T. Seaborg | 1955 | |||
| Mercuri | Hg | 80 | 12 | 200,59 | 13,55 | -38,9 | 356,6 | desconegut | prehistòric |
| Molibdè | Mo | 42 | 6 | 95,94 | 10,28 | 2617 | 5560 | Carl Wilhelm Scheele | 1778 |
| Moscovi | Mc | 115 | 15 | ||||||
| Neó | Ne | 10 | 18 | 20,1797 | 0,000 84 | -248,7 | -246,1 | William Ramsay i Morris Travers | 1898 |
| Neodimi | Nd | 60 | 3 | 144,24 | 7 | 1010 | 3127 | von Welsbach | 1895 |
| Neptuni | Np | 93 | 3 | 237,0482 | 20,48 | 640 | 3902 | McMillan i Abelson | 1940 |
| Nihoni | Nh | 113 | 13 | ||||||
| Niobi | Nb | 41 | 5 | 92,90638 | 8,58 | 2468 | 4927 | Hatchet | 1801 |
| Níquel | Ni | 28 | 10 | 58,69 | 8,91 | 1453 | 2732 | Axel Fredrik Cronstedt | 1751 |
| Nitrogen | N | 7 | 15 | 14,00674 | 0,001 17 | -209,9 | -195,8 | Daniel Rutherford | 1772 |
| Nobeli | No | 102 | 3 | 259,1009 | Glenn T. Seaborg | 1958 | |||
| Oganessó | Og | 118 | 18 | ||||||
| Or | Au | 79 | 11 | 196,96654 | 19,32 | 1064,4 | 2940 | desconegut | prehistòric |
| Osmi | Os | 76 | 8 | 190,2 | 22,61 | 3045 | 5027 | Tenant | 1803 |
| Oxigen | O | 8 | 16 | 15,9994 | 0,001 33 | -218,4 | -182,9 | Joseph Priestley, Carl Wilhelm Scheele i Antoine Laurent Lavoisier | 1774 |
| Pal·ladi | Pd | 46 | 10 | 106,42 | 12,02 | 1552 | 3140 | Wollaston | 1803 |
| Platí | Pt | 78 | 10 | 195,08 | 21,45 | 1772 | 3827 | Scaliger | 1557 |
| Plom | Pb | 82 | 14 | 207,2 | 11,34 | 327,5 | 1740 | desconegut | prehistòric |
| Plutoni | Pu | 94 | 3 | 244,0642 | 19,74 | 641 | 3327 | Glenn T. Seaborg | 1940 |
| Poloni | Po | 84 | 16 | 208,9824 | 9,2 | 254 | 962 | Marie Curie i Pierre Curie | 1898 |
| Potassi | K | 19 | 1 | 39,0983 | 0,86 | 63,7 | 774 | Humphry Davy | 1807 |
| Praseodimi | Pr | 59 | 3 | 140,90765 | 6,48 | 931 | 3212 | von Welsbach | 1895 |
| Prometi | Pm | 61 | 3 | 146,9151 | 7,22 | 1080 | 2730 | Marinsky i Glendenin | 1945 |
| Protactini | Pa | 91 | 3 | 231,0359 | 15,37 | 1554 | 4030 | Soddy, Cranston i Hahn | 1917 |
| Radi | Ra | 88 | 2 | 226,0254 | 5,5 | 700 | 1140 | Marie Curie i Pierre Curie | 1898 |
| Radó | Rn | 86 | 18 | 222,0176 | 0,009 23 | -71 | -61,8 | Friedrich E. Dorn | 1900 |
| Reni | Re | 75 | 7 | 186,207 | 21,03 | 3180 | 5627 | Noddack, Tacke i Berg | 1925 |
| Rodi | Rh | 45 | 9 | 102,9055 | 12,41 | 1966 | 3727 | Wollaston | 1803 |
| Roentgeni | Rg | 111 | 11 | 272 | Gesellschaft für Schwerionenforschung | 1994 | |||
| Rubidi | Rb | 37 | 1 | 85,4678 | 1,53 | 39 | 688 | Robert W. Bunsen i Gustav R. Kirchhoff | 1861 |
| Ruteni | Ru | 44 | 8 | 101,07 | 12,45 | 2310 | 3900 | Claus | 1844 |
| Rutherfordi | Rf | 104 | 4 | 261,1087 | Flerow oder Ghiorso | 1964/69 | |||
| Samari | Sm | 62 | 3 | 150,36 | 7,54 | 1072 | 1778 | Paul Émile Lecoq de Boisbaudran | 1879 |
| Seaborgi | Sg | 106 | 6 | 263,1182 | Oganessian | 1974 | |||
| Seleni | Se | 34 | 16 | 78,96 | 4,82 | 217 | 685 | Jöns Jacob Berzelius | 1817 |
| Silici | Si | 14 | 14 | 28,0855 | 2,33 | 1410 | 2355 | Jöns Jacob Berzelius | 1824 |
| Sodi | Na | 11 | 1 | 22,989768 | 0,97 | 97,8 | 892 | Humphry Davy | 1807 |
| Sofre | S | 16 | 16 | 32,066 | 2,06 | 113 | 444,7 | desconegut | prehistòric |
| Tal·li | Tl | 81 | 13 | 204,3833 | 11,85 | 303,6 | 1457 | William Crookes | 1861 |
| Tàntal | Ta | 73 | 5 | 180,9479 | 16,68 | 2996 | 5425 | Anders Gustaf Ekeberg | 1802 |
| Tecneci | Tc | 43 | 7 | 98,9063 | 11,49 | 2172 | 5030 | Perrier i Segrè | 1937 |
| Tel·luri | Te | 52 | 16 | 127,6 | 6,25 | 449,6 | 990 | von Reichenstein | 1782 |
| Tennes | Ts | 117 | 17 | ||||||
| Terbi | Tb | 65 | 3 | 158,92534 | 8,25 | 1360 | 3041 | Mosander | 1843 |
| Titani | Ti | 22 | 4 | 47,88 | 4,51 | 1660 | 3260 | Gregor i Klaproth | 1791 |
| Tori | Th | 90 | 3 | 232,0381 | 11,72 | 1750 | 4787 | Jöns Jacob Berzelius | 1829 |
| Tuli | Tm | 69 | 3 | 168,93421 | 9,32 | 1545 | 1727 | Per Teodor Cleve | 1879 |
| Tungstè | W | 74 | 6 | 183,85 | 19,26 | 3407 | 5927 | Fausto de Elhúyar i Juan José de Elhúyar | 1783 |
| Urani | U | 92 | 3 | 238,0289 | 18,97 | 1132,4 | 3818 | Klaproth | 1789 |
| Vanadi | V | 23 | 5 | 50,9415 | 6,09 | 1890 | 3380 | Andrés Manuel del Río Fernández | 1801 |
| Xenó | Xe | 54 | 18 | 131,29 | 0,004 49 | -111,9 | -107 | William Ramsay i Morris Travers | 1898 |
| Zinc | Zn | 30 | 12 | 65,39 | 7,14 | 419,6 | 907 | desconegut | prehistòric |
| Zirconi | Zr | 40 | 4 | 91,224 | 6,51 | 1852 | 4377 | Klaproth | 1789 |
