La natura de les forces que donen lloc a l’enllaç químic fou objecte de moltes especulacions (ja Demòcrit suposava que els àtoms eren ganxuts), però restà forçosament desconeguda fins a l’establiment de la constitució de l’àtom. Ben abans, J.J. Berzelius i S. Arrhenius pressentiren, tanmateix, que es tractava de forces elèctriques. Actualment hom sap que l’enllaç resulta de les forces de Coulomb entre les càrregues elèctriques positives i negatives del nucli i els electrons. La petitesa de la massa dels constituents atòmics, i en especial de l’electró, fa que només els sigui aplicable la mecànica quàntica i, per tant, la descripció matemàtica de l’enllaç és generalment complicada. La teoria quàntica de l’enllaç és la base de la teoria moderna de la valència.
La creació d’un enllaç entre dos àtoms o més va acompanyada, obligatòriament, d’alliberament d’energia i implica llur acostament fins a una certa distància d’equilibri, anomenada distància d’enllaç. La distància interatòmica és, doncs, el criteri experimental de l’existència d’enllaç, i un enllaç és més fort i allibera més energia com més petita és aquesta distància. Malgrat la possibilitat teòrica d’un estudi unificat, resulta còmode de considerar separadament tres enllaços diferents, l’iònic, el covalent i el metàl·lic, cadascun dels quals representa un cas límit, tots els casos intermedis essent també possibles. La diferència entre aquests tres enllaços està en la diferent distribució electrònica al veïnatge dels àtoms enllaçats i, doncs, en la diversa direccionalitat de les forces que en resulten. En tots casos, cada nucli conserva prop seu els electrons del cor, és a dir, els que no formen part de la capa de valència. Els electrons de valència, altrament, són localitzats d’una manera diversa.
En l’enllaç iònic els electrons de valència es redistribueixen fins a obtenir, per a cada àtom, una configuració electrònica de gas noble o de pseudogas noble; això dona lloc a la formació d’ions de signe contrari, i la densitat electrònica passa per un mínim en l’espai entre ambdós ions. En una primera aproximació hom pot considerar, doncs, que cada ió exerceix un control exclusiu sobre els seus electrons, i les forces d’enllaç, poc direccionals, es poden derivar de les interaccions electroestàtiques clàssiques entre ions. La formació conjunta dels ions absorbeix sempre energia, i l’energia alliberada en formar-se l’enllaç prové de llur acostament. Hom anomena energia reticular la que resulta de la formació d’un reticle cristal·lí iònic a partir dels ions lliures en estat gasós. L’energia reticular és calculable, i hom la pot deduir també d’una manera indirecta mitjançant el cicle de Born-Haber.
En l’enllaç covalent (les primeres interpretacions del qual provenen de W. Kossel i G.N. Lewis), dos àtoms (enllaç dicèntric) o diversos àtoms (enllaç policèntric) comparteixen tots o alguns de llurs electrons de valència. Els electrons en comú, situats en un nivell d’energia més baix que en els àtoms primitius, són localitzats sobretot en certes regions de l’espai. En general, la densitat electrònica presenta valors màxims en la regió intermèdia entre els àtoms enllaçats, i les forces d’enllaç són molt direccionals. L’energia alliberada en formar-se l’enllaç és en relació directa amb la superposició dels orbitals atòmics (orbital). D’altra banda, els electrons que donen lloc a l’enllaç van per parells i cal que tinguin spins oposats, a fi de complir amb el principi de Pauli.
En l’enllaç metàl·lic o enllaç de bandes els àtoms poden ésser considerats com havent perdut llurs electrons de valència, però aquests no han estat cedits a uns altres àtoms, sinó que resten “lliures”, i així és obtinguda una estesa de cations submergits en una “mar” d’electrons. Alternativament hom pot dir que els orbitals atòmics de valència se superposen en gran nombre i donen lloc a bandes d’energia contínues, en les quals els electrons es desplacen lliurement. Els electrons resten totalment deslocalitzats, és a dir, no hi ha cap regió de l’espai privilegiada, i l’enllaç és totalment no direccional.
D’aquests tres enllaços, el més important, des del punt de vista químic, és l’enllaç covalent, que és l’únic que permet l’existència de sòlids moleculars, és a dir, de sòlids formats per l’agregació de molècules discretes, unides entre elles mitjançant forces de Van der Waals. En el cas de l’enllaç iònic o del metàl·lic, és el cristall en el seu conjunt el qual ha d’ésser considerat com una sola molècula, car els enllaços s’hi estenen indefinidament en totes tres direccions de l’espai. Hi ha també molècules gegants amb enllaços purament covalents, però la continuïtat de la molècula prové aleshores de la repetició indefinida en una, en dues o en totes tres direccions d’enllaços localitzats. Les propietats mecàniques i altres propietats físiques de les substàncies depenen en gran part del tipus d’enllaç. Els sòlids covalents no condueixen mai l’electricitat, i tenen punts de fusió baixos o elevats, segons que siguin constituïts per molècules discretes (com és ara el naftalè) o molècules gegants (com ara el quars). Els sòlids metàl·lics són tenaços, dúctils, opacs, amb l’anomenat llustre metàl·lic, i són bons conductors de la calor i de l’electricitat, propietats que s’expliquen totes per la presència dels electrons lliures. La teoria de l’enllaç covalent utilitza obligatòriament mètodes d’aproximació i empra com a punt de partida dos models distints, el de l’enllaç de valència i el dels orbitals moleculars. Malgrat llurs diferències, ambdós menen a resultats convergents.
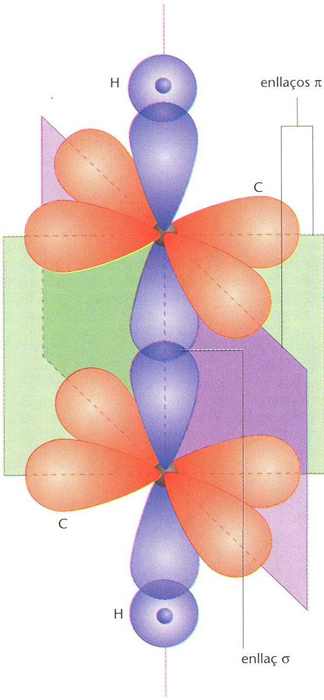
En la teoria de l’enllaç de valència, hom suposa que els orbitals atòmics conserven llur individualitat i que tot passa com si hi hagués entre ells un bescanvi d’electrons segons el concepte de mesomeria. Els orbitals atòmics que participen en l’enllaç poden ésser els normals o bé orbitals híbrids (hibridació), que permeten d’assolir valors màxims del recobriment. En la teoria dels orbitals moleculars, hom substitueix els orbitals atòmics monocèntrics per un nombre igual d’orbitals policèntrics que s’estenen al conjunt de la molècula i que hom obté, generalment, combinant linealment orbitals atòmics de valència d’energies similars. Segons que llur ocupació, per un parell d’electrons, condueixi a forces atractives, repulsives o a una resultant nul·la, els orbitals moleculars són anomenats, respectivament, enllaçants, antienllaçants o no enllaçants. Hom anomena ordre d’enllaç el nombre de parells d’electrons en orbitals enllaçants, excepte el de parells en orbitals no enllaçants. El concepte d’ordre d’enllaç racionalitza el d’enllaç múltiple, introduït al segle XIX per Loschmidt. Els ordres d’enllaç 1, 2 i 3 corresponen a l’enllaç simple, al doble i al triple de la teoria de l’enllaç de valència (compartició d’un, dos o tres parells d’electrons). Com més elevat és l’ordre, més fort és l’enllaç, hi ha més energia alliberada i la distància és menor. Els orbitals moleculars i els enllaços que resulten de llur ocupació es classifiquen segons llur simetria relativament a l’eix d’enllaç. Els més corrents són els que tenen simetria cilíndrica al voltant d’aquest eix (enllaços σ) i els que tenen un pla nodal (de densitat electrònica nul·la) que passa per aquest eix (enllaços π). Un enllaç simple correspon, en general, a un enllaç σ, un de doble correspon a la superposició d’un enllaç σ i d’un π, i un de triple, a la superposició d’un enllaç σ i de dos enllaços π amb plans nodals perpendiculars. Malgrat que en l’enllaç covalent els electrons que hi participen siguin compartits entre els àtoms enllaçats, quan l’enllaç és heteronuclear, és a dir, quan té lloc entre àtoms diferents, la distribució de les càrregues elèctriques no és simètrica i l’enllaç té una certa polaritat. Quan, en un enllaç covalent entre dos àtoms, els electrons del parell que forma l’enllaç no provenen un de cada àtom sinó ambdós del mateix, l’enllaç és anomenat covalent datiu, semipolar o de coordinació. L’enllaç de coordinació és un enllaç covalent ordinari però amb polaritat, en general, elevada. Un cas freqüent d’enllaç molt polar és el de moltes molècules gegants on l’enllaç és, de fet, intermedi entre iònic i covalent, i hom el pot considerar com un enllaç iònic en el qual s’ha produït una polarització dels núvols electrònics per efecte de les càrregues dels ions veïns, d’on s’esdevé una considerable superposició d’orbitals. En realitat, no pot ésser traçada cap frontera precisa entre l’enllaç iònic i el covalent, i és per convinença que, quan llur polaritat és petita, els enllaços són considerats covalents, i quan és elevada, iònics. Un altre cas particular important en el qual la contribució electroestàtica és especialment alta és el de l’enllaç dèbil anomenat enllaç hidrogen.