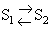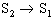El pas d’un al.lòtrop a un altre no sempre és possible directament (cal, per exemple, canviar d’estat o fornir energia altra que la tèrmica). El terme al.lotropia fou introduït per Berzelius per als elements i bé que ha estat també aplicat a composts, altres expressions són aleshores preferibles (polimorfisme, polimerització, etc). Quan l’al·lotropia es manifesta només en estat sòlid, és un fenomen d’estructura originat per la diferent disposició dels àtoms en el cristall (cas del carboni). Quan es manifesta també en estats líquit i, sobretot, gasós, és motivada per l’existència d’espècies de diferent atomicitat, i les propietats químiques poden diferir aleshores notablement (cas de l’oxigen O 2 i de l’ozó O 3 ). Els al·lòtrops d’un mateix element són designats habitualment de maneres molt diverses (amb noms distints, mitjançant adjectius, etc). La IUPAC recomana, per als noms sistemàtics d’indicar les diferències d’atomicitat amb prefixos numerals, precedits eventualment dels prefixos ciclo - o catena - si cal precisar l’estructura molecular (trioxigen designa O 3 , ciclooctasofre S 8 , etc.) Si només l’estructura cristal.lina difereix, n'hi ha prou amb esmentar-la tal com ho fa en els altres casos de polimorfisme. Segons la manera com té lloc la transició entre els al·lòtrops, l’al·lotropia és enantiotròpica, monotròpica o dinàmica. (Alguns casos com el de l’oxigen, no entren en cap d’aquestes categories). En l' al.lotropia enantiotròpica la transició entre dos al·lòtrops S 1 i S 2 és reversible: