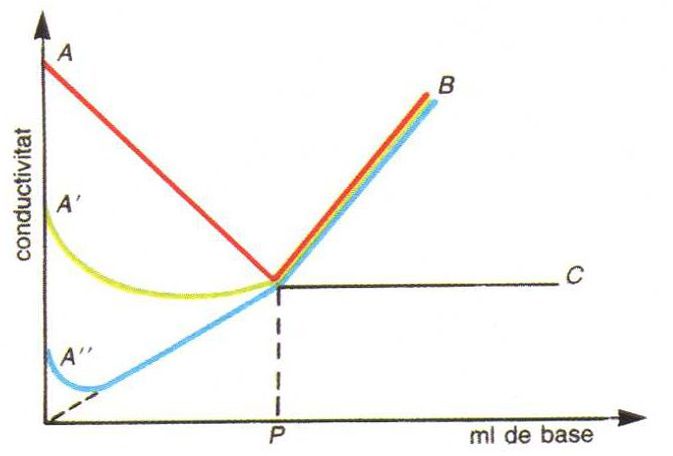
Com que la conductivitat electrolítica depèn de la mobilitat dels ions presents en la solució i de llurs concentracions, l’addició d’un reactiu en provoca canvis importants sempre que doni lloc a la desaparició d’una espècie iònica de la solució (sigui per formació d’un compost poc dissociat o d’una sal insoluble) i a la seva substitució per quantitats equivalents d’un dels ions del reactiu de mobilitat diferent de la de l’espècie eliminada. Així, hom pot dur a terme conductimètricament volumetries de neutralització, de precipitació i de formació de complexos, però només en casos favorables també d’oxidoreducció. Si la reacció volumètrica té lloc entre electròlits forts i la seva constant d’equilibri és prou gran, la corba de valoració (gràfic de la conductivitat mesurada en funció del volum de reactiu afegit) resulta formada per dos segments rectilinis que s’intersecten en el punt final; en cas contrari, o bé si els electròlits són massa diluïts, la corba de valoració té una forma rodona en les proximitats del punt final, que hom ha de determinar aleshores per extrapolació dels segments rectilinis. L’anàlisi conductimètrica té aplicació pràctica en la valoració de substàncies per a les quals hom no disposa d’indicadors químics adequats, o en la de solucions on no sigui fàcilment visible el canvi de color dels indicadors, com són les solucions acolorides, tèrboles o extremament diluïdes. Com que la conductivitat mesurada depèn de totes les espècies iòniques presents en la solució problema i no solament de l’espècie que hom valora, la precisió de les determinacions minva ràpidament en créixer la concentració de sals estranyes, la presència de les quals limita fortament el camp d’aplicació de la tècnica. Les mesures són fetes generalment en conductímetres de corrent altern, per evitar els fenòmens de polarització que produiria un corrent continu. Hom pot treballar també amb corrents d’alta freqüència; la tècnica aleshores rep el nom d'oscil·lometria.
f
Química