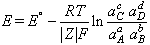Hom pot fixar l’origen de l’electroquímica en les experiències d’A. Volta, seguides pels treballs de H. Davy i M. Faraday i la teoria de S. Arrhenius sobre els electròlits. El 1905 Tafel enuncià l’equació que relaciona la ddp entre dues fases amb la densitat del corrent mesurat. El 1890, però, W. Nernst ja havia establert l’equació que porta el seu nom i que relaciona la ddp mesurada i l'activitat de l’ió que és en dissolució. Butler interpretà cinèticament els potencials de Nernst, Gurney introduí la mecànica quàntica per a explicar la transferència de càrrega i Frunkin estudià el fenomen de la doble capa, mentre que Debye i Hückel presentaren la seva teoria mecanicoestadística sobre les dissolucions iòniques, completada per Onsager. Aquesta teoria s’adeia amb el comportament de les dissolucions diluïdes, però fallava en aplicar-la a l’estudi de les dissolucions concentrades. Els ulteriors camins d’investigació s’orientaren vers l’estudi de la cinètica de l’elèctrode i dels processos interficials; hom desenvolupà el concepte de sobretensió i de densitat de corrent d’intercanvi i interpretà el tipus de transferència electrònica del procés electroquímic quànticament mitjançant l’efecte túnel. La variació d’entalpia lliure ΔG d’una reacció d’electroquímica va relacionada amb la ddp e entre els elèctrodes mitjançant l’equació ΔG = -|Z|Fe, Z essent el nombre d’equivalents que reaccionen, i F els faradays que hi passen. Considerant una cel·la electrolítica en la qual hi ha un equilibri aA + bB ⇌ cC + dD, aplicant l’equació de Nernst hom en dedueix l’expressió