És emprat gairebé sempre en forma de solució aquosa, anomenada àcid clorhídric, la qual reacciona amb els metalls, els hidròxids i els carbonats per a produir clorurs. Amb l’amoníac gasós el HCl forma fums de clorur amònic, segons la reacció NH3 + ClH →NH4 Cl. Hom obté el clorur d’hidrogen al laboratori mitjançant la reacció NaCl + H2 SO4 →NaHSO4 + HCl, i a escala industrial en una segona fase,
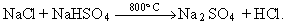
Un altre mètode és la combinació del clor amb l’hidrogen: H2 + Cl2 →2HCl + 22 kcal. Un tercer mètode industrial es fonamenta en la reacció sobre coc a 350°C en presència d’un catalitzador de ferro. El clorur d’hidrogen és molt emprat en la indústria, com és ara en l’obtenció de clorhidrats i de clorurs i en la cloració del cautxú.
Propietats del clorur d’hidrogen
| pes molecular | 36,46 |
| densitat | 1,00045 g/l |
| punt de fusió | −114,8ºC |
| punt d’ebullició | −84,9ºC |
| temperatura crítica | 51,4ºC |
| pressió crítica | 8,32 MPa |
| solubilitat en 100 cm3 d’aigua a 0ºC | 82,3 g |