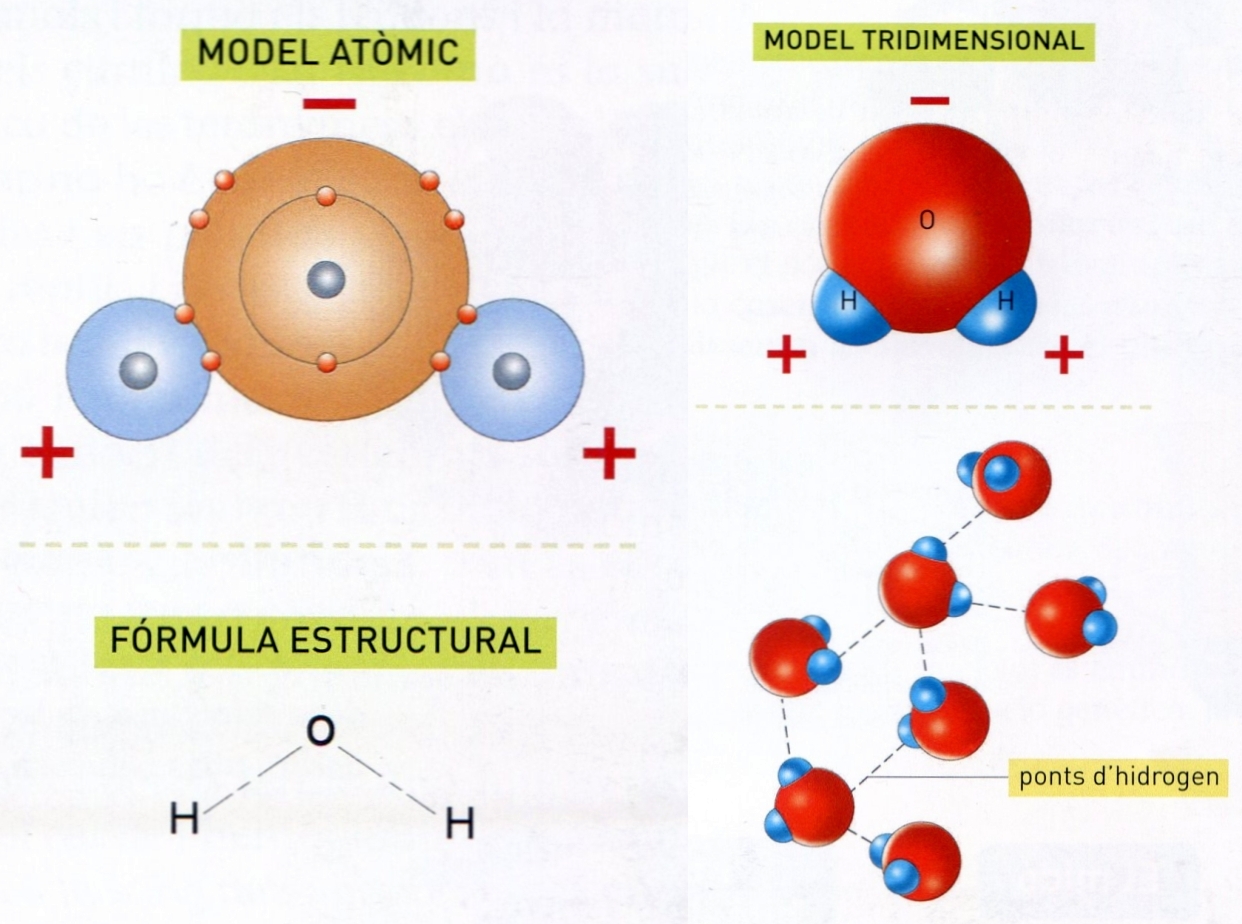
Propietats fisicoquímiques de l’aigua
Composició
La seva composició fou establerta per síntesi per Cavendish el 1781 fent explotar una mescla d’hidrogen i oxigen: 2H + O2 → 2H2O.
L’anàlisi fou feta per Lavoisier i Meusnier, el 1783, descomponent el vapor amb ferro roent: 4H2O + 3Fe → Fe3O4 + 4H2.
La descomposició electrolítica: H2O2 + ½O2 fou realitzada per primera vegada per Nicholson i Carlisle l’any 1800. La represa d’aquests experiments amb mètodes més precisos permeté de determinar exactament la composició ponderal, establir la fórmula definitiva i confirmar les lleis fonamentals de la química.
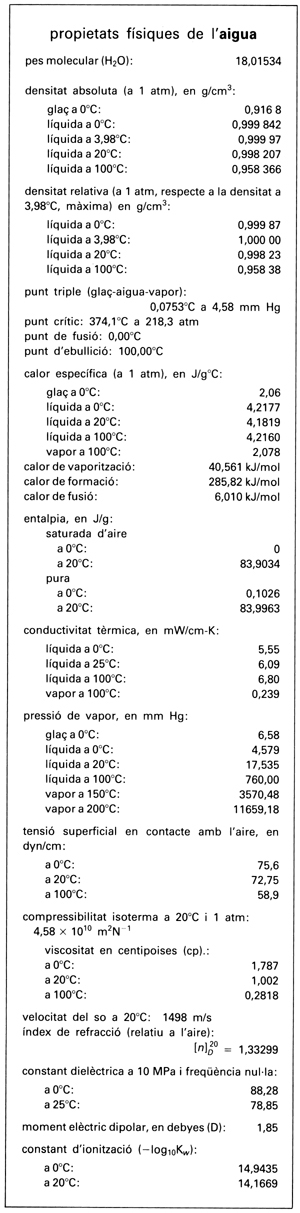
Propietats físiques de l’aigua
La descoberta dels isòtops (1913) replantejà des d’un nou punt de vista el problema de la composició de l’aigua i conduí a la separació de l’aigua pesant. L’aigua d’origen natural és, en efecte, una mescla de H2O i de molt petites quantitats de D2O i HDO i, a més, conté, en proporcions gairebé no mesurables, les combinacions derivades dels isòtops 17O i 18O i del triti. L’estructura de l’aigua ha estat molt estudiada. L’espectrografia mostra que en l’estat de vapor els dos enllaços H—O formen un angle de 104° 27’ amb una distància entre els centres atòmics de 0,96 Å. L’enllaç H—O és covalent, però la diferència en les electronegativitats li dóna un cert caràcter iònic (avaluat en un 37%) i provoca (juntament amb l’angle de valència) una polarització elèctrica, és a dir, la formació d’un dipol. L’estructura a l’estat sòlid ha estat determinada per difracció de raigs X i neutrònica. En el reticle cristal·lí, cada oxigen està envoltat tetraèdricament d’altres 4, amb distància entre centres de 2,76 Å. Aquesta estructura, molt oberta (volum aproximadament doble del que correspondria a esferes apilades), és la previsible en la hipòtesi de formació d’enllaços hidrogen O—H—O. De fet, a molt baixa temperatura, hi ha els 4 enllaços possibles per molècula. No obstant això, les molècules d’aigua conserven llur individualitat, car l’hidrogen està prop d’un oxigen (0,99 Å) i allunyat de l’altre (1,77 Å). El nombre total d’enllaços hidrogen decreix amb la temperatura i en el moment de la fusió, però continua essent elevat fins a l’ebullició. L’estructura de l’aigua líquida és, fins a uns 4°C, molt similar a la del glaç. Per damunt de 4°C l’estructura és encara pseudocristal·lina, però més compacta, i cal arribar a 150°C o més (sota pressió) perquè domini l’estructura més típica dels líquids (empaquetament màxim de les molècules).
A la pressió ordinària l’aigua líquida és, doncs, un edifici macromolecular lacunar, amb buits on poden intercalar-se altres molècules o ions capaços de rompre els enllaços d’hidrogen, cosa que explica les excepcionals propietats de l’aigua com a solvent. L’equilibri dinàmic entre les tres estructures (entre les quals no hi ha discontinuïtat sinó transició contínua) i la presència dels enllaços hidrogen expliquen també les propietats físiques anormals de l’aigua líquida.
Polimorfisme
Del punt de vista de les propietats físiques l’aigua és, en efecte, una de les substàncies més complexes. Una particularitat interessant és el polimorfisme a l’estat sòlid. El glaç pot existir en 6 formes cristal·lines diferents, de les quals la corrent és l’estable per sota de 2.000 atm. El diagrama d’estat presenta, doncs, a més del punt triple ordinari, altres punts triples on coexisteixen dues fases sòlides i una de líquida o tres fases sòlides. Això no obstant, allí on l’aigua manifesta un comportament més anormal és en l’estat líquid. Les seves principals anomalies són: el fet que a 0°C la densitat del glaç és aproximadament 1/12 inferior a la de l’aigua líquida; la màxima de densitat a 3,98°C; els valors elevats de les temperatures de fusió i d’ebullició, que normalment haurien d’ésser —100°C i —80°C aproximadament, tal com l’extrapolació dels valors obtinguts per a H2Te,H2Se i H2S indica; la disminució de la viscositat en augmentar la pressió (per sota de 30°C) i de la compressibilitat en augmentar la temperatura; els valors elevats de les calors específica, de fusió i de vaporització i de la constant dielèctrica. Tenen sobretot conseqüències pràctiques les anomalies de la densitat i els valors elevats de les calors específica i latent.
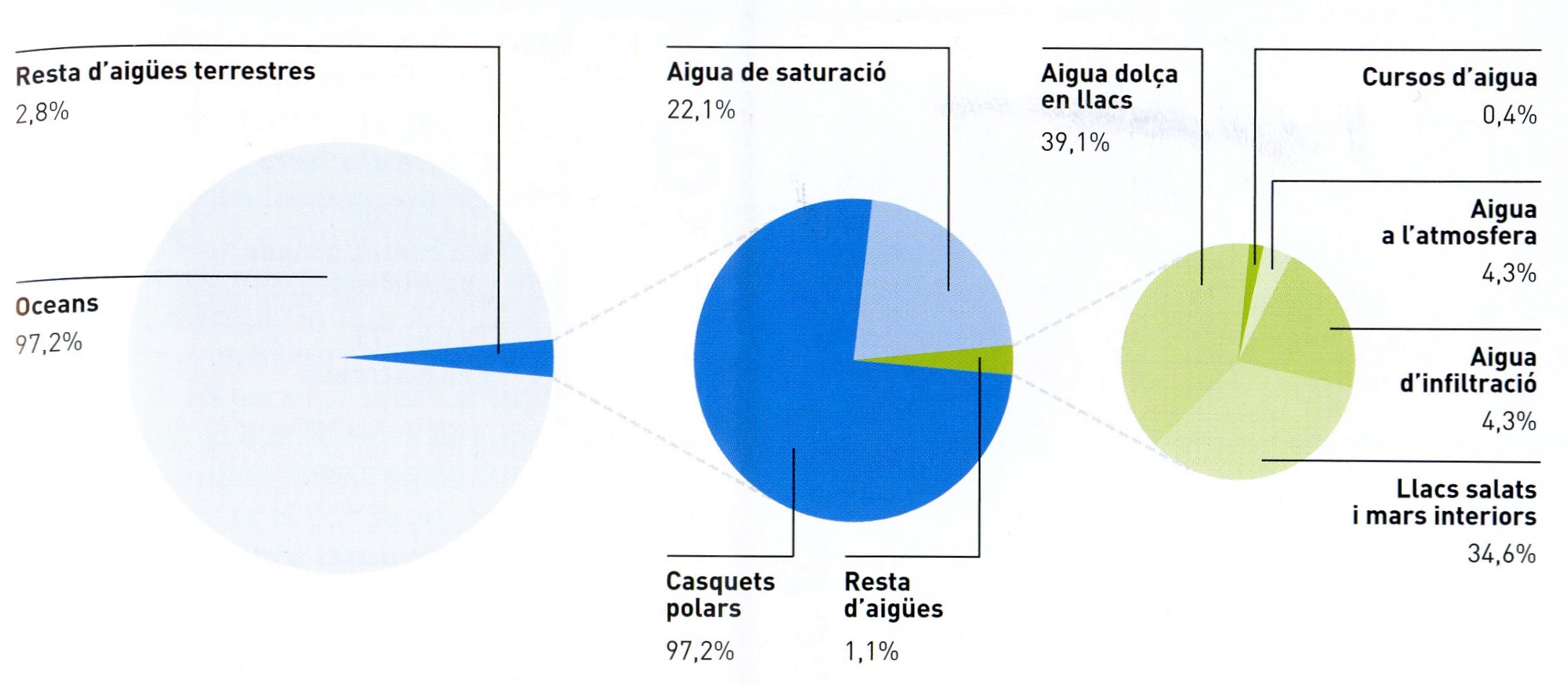
Distribució dels recursos hídrics
© Fototeca.cat
L’expansió de l’aigua en solidificar-se fa rebentar les canonades i els radiadors dels automòbils. Però, conjuntament amb la màxima de densitat de l’aigua líquida, evita la congelació total dels rius i els llacs a l’hivern, i de la mar a les regions àrtiques (i, per tant, la destrucció de la vida aquàtica i la transformació climàtica que en derivarien). D’altra banda, els valors elevats de les calors específica de fusió i de vaporització, fan que les masses d’aigua actuïn com a volant tèrmic i influeixin enormement sobre el clima. L’aigua quan és pura ( aigua destil·lada, aigua bidestil·lada) és incolora (almenys en capa prima), inodora i insípida. La seva conductivitat elèctrica és molt baixa (aigua de conductivitat).
Estabilitat
Químicament és molt estable i fortament exotèrmica. L’entalpia de formació estàndard a 25°C és (aigua líquida) H°for = —68,32 kcal/mol. La dissociació a altes temperatures (descoberta per Sainte-Claire Deville el 1856) resta molt limitada: 0,77% a 1 984°C, de l’ordre del 10% pels volts dels 2 500°C. La principal característica química de l’aigua és, sens dubte, d’ésser el més universal de tots els solvents. A més, cal esmentar: la seva capacitat de donar, amb substàncies de tota mena, els compostos moleculars anomenats hidrats; les reaccions d’hidròlisi i de descomposició i, en fi, el seu poder catalític. El poder solvent de l’aigua es manifesta, sobretot, envers les substàncies polars. La solubilitat dels gasos varia d’acord amb la llei d’Henry —almenys fins a 3 o 4 atm— i disminueix amb la temperatura. La solubilitat dels líquids i dels sòlids augmenta amb la temperatura, però hi ha nombroses excepcions. A causa de la seva constant dielèctrica elevada l’aigua dóna lloc, més que cap altre solvent, a la dissociació electrolítica. Els ions, i en particular els cations (sobretot els petits) s’envolten de molècules d’aigua. La solvatació es produeix, o bé per formació d’enllaços hidrogen (cas dels anions) o de coordinació (cas de l’ió H+ que dóna H₃O⁺), o bé per simple atracció electroestàtica entre l’ió i el dipol de l’aigua. En les reaccions de descomposició l’aigua, sota la influència de substàncies àvides d’oxigen o d’hidrogen, es descompon alliberant un dels seus components. Atesa l’electronegativitat elevada de l’oxigen, només el fluor és capaç de descompondre l’aigua alliberant-lo en fred: F2 + H2O → H2F2 + ½O2 (i donant F₂O com a subproducte). En canvi els cossos simples que alliberen hidrogen són molt nombrosos i comprenen alguns no-metalls (carboni, silici i bor) i tots els metalls més electropositius que l’hidrogen. Els alcalins i alcalinoterris reaccionen en fred: Na + H2O → Na+ + OH- + ½H2.
D’altres necessiten temperatures mitjanes (magnesi) o elevades (ferro). En alguns casos (alumini) la reacció a temperatura moderada s’atura de seguida, per formació d’una pel·lícula protectora d’òxid. La reacció amb el carboni es produeix al roig i dóna l’anomenat gas d’aigua: C + H2O → CO + H2.
Les reaccions amb el clor (aigua de clor) i amb molts carburs metàl·lics (acetilè) són reaccions d’hidròlisi. Com a catalitzador, l’aigua té la mateixa importància que com a solvent, ja que són nombroses les reaccions que no es produeixen sense la seva presència. Així, les reaccions de l’oxigen amb el carboni, l’òxid de carboni, el sofre, el fòsfor i l’hidrogen, normalment molt vives i àdhuc explosives, no tenen lloc (o són molt lentes) quan els reactants són perfectament secs. Ben secs, tampoc no reaccionen, per exemple, l’hidrogen i el clor, l’amoníac i el clorur d’hidrogen, el fluor i el vidre. En alguns casos, almenys, l’efecte catalític de l’aigua s’explica per la dissociació en ions a què dóna lloc.
Analítica
Atesa la influència de l’aigua sobre les propietats de molts productes, la seva determinació analítica revesteix una gran importància. Els mètodes són variadíssims i en cada cas és utilitzat el que millor s’ajusta a les característiques del problema. Un exemple típic és la determinació de la humitat atmosfèrica, efectuada amb els higròmetres. Qualitativament la presència d’aigua és posada en evidència mitjançant reactius químics (nitrur magnèsic, carbur de calci, sulfat de coure anhidre, etc) o mesures físiques; un mètode molt general i molt sensible és l’espectrografia infraroja. Quan no es requereix una gran sensibilitat, són utilitzats els dispositius anomenats higroscopis. Per a la determinació quantitativa, el mètode més clàssic és la pesada, efectuada abans i després de dessecació en estufa o bé amb una termobalança. Com que la velocitat d’eliminació de l’aigua depèn molt de la natura del producte, aquest és mantingut a l’estufa (a la màxima temperatura que no provoca descomposició, i, si cal, al buit) fins a pes constant. La termobalança, que permet de representar gràficament la dessecació, dóna resultats més exactes i, en una mateixa substància, discrimina entre els diversos tipus d’aigua, lligats de manera diferent. Altres mètodes físics es basen en mesures colorimètriques, turbidimètriques, espectromètriques, etc. Un mètode corrent es basa en la destil·lació de l’aigua, arrossegant-la amb un solvent que doni un azeòtrop volàtil. Els mètodes químics utilitzen la combinació amb un deshidratant (anhídrid fosfòric, perclorat de magnesi anhidre, hidròxid potàssic fos, àcid sulfúric concentrat, etc), la hidròlisi de clorurs d’àcids orgànics, la gasometria de l’hidrogen produït per reacció amb metalls alcalins o hidrurs, etc. El mètode actualment més important és el de Karl Fischer, que utilitza com a reactiu una solució de iode i d’anhídrid sulfurós en una mescla de piridina i metanol anhidres. En presència d’aigua es produeix la reacció: I2 + 2H2O + (C5H5N)2SO2 + 2C5H5N (C5H5N)2 · H2SO4 + 2C5H5N · HI
i el reactiu, inicialment bru, es descolora. La reacció és molt sensible i, amb tècniques microanalítiques, permet de determinar quantitats d’aigua inferiors a 1 mg. En certs casos, a la indústria, interessa de conèixer la humitat de certs sòlids molt de pressa, o de manera contínua, però sense gran precisió. Són utilitzats aleshores aparells basats en mesures elèctriques (de resistència o de constant dielèctrica), automàtics o de maneig molt simple, que necessiten un calibratge previ. Llur principal aplicació és la determinació de la humitat dels productes d’origen orgànic (fusta, cuir, tabac, cereals, paper en la mateixa màquina, etc).
Aigües naturals
El cicle de l’aigua
L’aigua es troba a la natura en forma de vapor (a l’atmosfera), líquida o sòlida (neu i glaç). Sota la influència de la calor solar segueix un cicle que fa possible la vida terrestre i modela per erosió les terres emergides. En forma d’aigua d’hidratació és possible de trobar-la en moltes roques. En conjunt, segons una estimació aproximada, l’aigua constitueix unes tres quartes parts en pes de l’escorça terrestre. L’aigua líquida natural no és mai pura i conté matèries en suspensió i nombroses substàncies dissoltes, variables en natura i en quantitat segons l’origen. Les més corrents són els gasos de l’aire (N2, O2 i CO2) i els ions Na⁺, Ca2⁺, Mg2⁺, HCO3-, Cl- SO42-. Quan la proporció d’ions Cl- i Na+ és molt elevada (cas de l’aigua de mar) l’aigua és salada. Les propietats i els usos possibles de l’aigua depenen molt de la quantitat de calci i magnesi presents i, des d’aquest punt de vista, les aigües es classifiquen en crues o molles (dites tècnicament dures) i en fines o fades (dites tècnicament blanes). A més de les substàncies esmentades, les aigües naturals poden contenir sílice, potassi, ferro i manganès i, més excepcionalment, sulfur d’hidrogen, fluor, brom, iode, liti, seleni, bor, arsènic, estronci i altres elements més rars. Certes aigües naturals són també radioactives (presència d’emanació). A aquestes substàncies inorgàniques s’afegeixen sovint les provinents de la contaminació amb residus vegetals, animals i humans, que poden ésser substàncies orgàniques, o bé llurs productes de degradació i d’oxidació (sals amòniques, nitrits i nitrats), o bé microorganismes. Finalment, moltes aigües, especialment les superficials i subàlvies, porten, en major o menor quantitat, residus industrials (aigües residuals).
L’aigua i els éssers vius
L’aigua com a element dels organismes
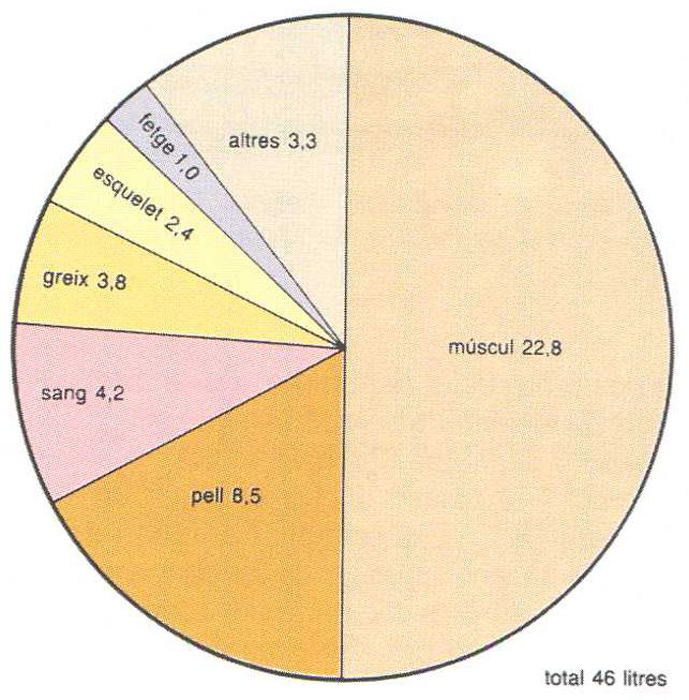
Volum d’aigua (en litres) per una persona de 70 kg de pes
© Fototeca.cat
La importància de l’aigua en els éssers vius és extraordinària a partir del mateix origen de la vida, la qual hi degué tenir lloc. Animals i plantes presenten continguts d’aigua gairebé sempre molt elevats, principalment en els teixits molt actius (cervell 85%, meristemes 93%), i en menor quantitat en els teixits menys actius (ossos 33%, tija llenyosa 55%). L’aigua és, doncs, tant més abundant com més gran és l’activitat fisiològica dels teixits. En el temps, és màxima en els teixits joves (embrió, meristema) i disminueix gradualment amb l’edat. Els continguts d’aigua més alts que es coneixen corresponen a les meduses (95-97%) i als embrions (embrió humà de 3 dies 97%). En canvi, nivells d’aigua inferiors al 20% representen la mort de tots els teixits actius. Això no obstant, es troben concentracions més baixes a les formes d’abiosi. La importància fisiològica de l’aigua va íntimament lligada a les seves excepcionals propietats físiques i químiques. La seva estructura polar li confereix propietats dissolvents i ionitzants que en fan un medi ideal per a mantenir disperses i convenientment ionitzades les molècules que formen part dels mecanismes de la vida (enzims, ions minerals, etc.), i les substàncies que han d’ésser transportades per l’organisme. La seva calor d’evaporació i la seva calor de fusió, excepcionalment altes, en fan un factor termoregulador bàsic (suor, transpiració, resistència a la glaçada). A causa de la gran calor específica de l’aigua, els éssers vius poden emmagatzemar molta calor i atenuar les variacions de temperatura. Té també una funció estructural, a causa de la gran resistència a la compressió, cosa que permet als organismes limitats per parets fines de conservar llur forma àdhuc sota grans pressions.
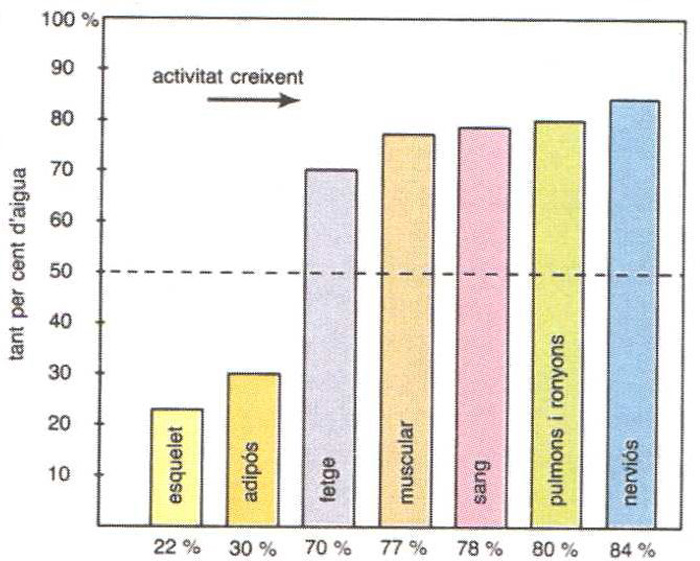
Percentatge d’aigua en la composició dels diferents teixits i òrgans humans
© Fototeca.cat
L’aigua es troba en tots els éssers vius en forma d’aigua intracel·lular, sigui combinada (unida als ions del protoplasma cel·lular), sigui lliure (constituint la resta). L’aigua del medi envolta les cèl·lules dels unicel·lulars en fase activa, i és substituïda en els pluricel·lulars per un medi intern integrat per l’aigua intersticial, que ocupa els espais entre les membranes (animals) i també els porus de la paret cel·lulòsica (plantes). La renovació de l’aigua intersticial depèn de l’aigua intercel·lular o circulant (saba als vegetals, plasma o sang als animals). L’aigua arriba a les plantes per absorció a càrrec de les arrels, i en surt per transpiració. Els animals l’obtenen principalment de la que beuen i de la que, en una gran proporció, porten els aliments. L’aigua participa activament en el metabolisme dels éssers vius. A les plantes, intervé en la fotosíntesi, com a fornidor d’hidrogen, i, tant a les plantes com en els animals, es forma en la fase catabòlica del metabolisme; aquesta aigua metabòlica pot bastar per a la vida d’alguns animals. Els animals perden aigua per excreció, transpiració i sudoració, i amb l’aire expirat.
Els organismes aquàtics
L’aigua representa un dels medis més adients al desenvolupament dels organismes. Així, el nombre d’organismes aquàtics supera de molt e dels que viuen en ambients aeris. Les condicions que afavoreixen la vida a l’ambient aquàtic, especialment a la mar (aigua de mar) són: la fàcil reactivitat de les substàncies químiques al si de l’aigua; la disponibilitat de tots els elements; la solubilitat dels gasos (oxigen, anhídrid carbònic), facilita pel moviment constant a què són sotmeses les masses d’aigua; la seva densitat, molt pròxima a la del protoplasma cel·lular, que facilita la suspensió i el desplaçament; la constant renovació del medi a causa del moviment esmentat, i el fet que als éssers que hi viuen no els cal defensar-se contra la dessecació.
Tractament i depuració d’aigües
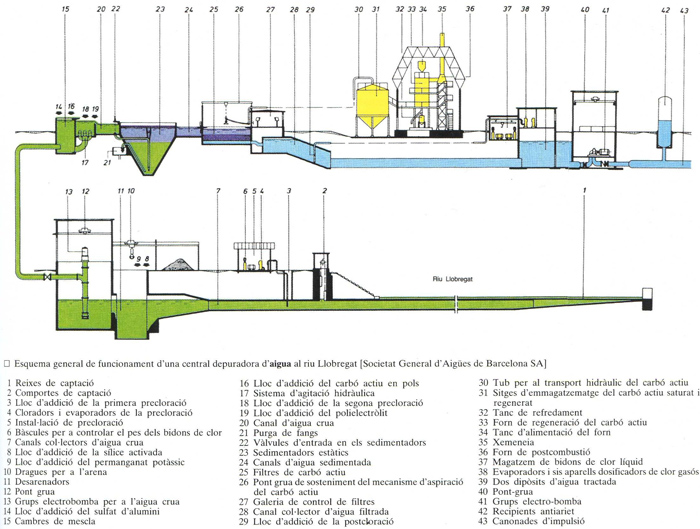
Esquema general de funcionament d’una central depuradora d’aigua al riu Llobregat [Societat General d’Aigües de Barcelona SA]
© Fototeca.cat
En general, les aigües són sotmeses a un conjunt d’operacions i tractaments per tal que esdevinguin aptes per al consum humà o per a unes determinades aplicacions industrials. Els tractaments poden ésser de naturalesa física, química o bacteriològica. El tractament físic consisteix a sotmetre l’aigua a decantació, natural o accelerada amb agents de floculació, i posteriorment a filtració, a través de llits filtrants de sorra o de carbó. Les aigües poc tèrboles poden ésser sotmeses directament a filtració, sense sotmetre-les a decantació. El tractament químic que té lloc per tal de millorar els caràcters químics de l’aigua consisteix a efectuar la decantació amb una quantitat adient de calç, per tal de reduir la duresa temporal o carbònica deguda als bicarbonats de calci o de magnesi, amb un control final del pH, amb l’addició generalment d’àcid sulfúric; pot consistir també a efectuar la filtració a través de bescanviadors iònics, per tal de reduir la duresa total de l’aigua, reduir-ne o eliminar-ne els cations indesitjables o desmineralitzar-la (dessalatge). Uns altres sistemes de potabilització, actualment en estat d’assaig o d’utilització poc perfeccionada, permetran de reduir-ne el cost, molt elevat en els procediments esmentats. El tractament bacteriològic és efectuat generalment per oxidació, bé directament amb gas clor, degudament regulat, bé amb composts clorats; la possibilitat de deixar a l’aigua una petita dosi de clor lliure residual garanteix la potabilitat bacteriològica de l’aigua en arribar als consumidors, malgrat que a la xarxa de distribució hi pugui haver punts de contaminació, a causa d’avaries o del mal estat de conservació. Per tal d’evitar el gust desagradable que el clor o els seus composts comuniquen a l’aigua, hom estudia actualment la seva ozonització en plantes especials (depuració d’aigües residuals).
L’aigua en els processos industrials
L’aigua intervé en els processos industrials fonamentalment, com a matèria primera incorporada, com a auxiliar indispensable de fabricació, com a refrigerant o transportador de calor, com a font d’energia i com a via de comunicació. En els inicis industrials, el paper de l’aigua en la localització de la indústria ha estat de caràcter selectiu i condicionant, però la seva funció i la seva influència han anat variant amb l’avenç del maquinisme i de la tècnica d’elaboració dels productes. L’aparició de la màquina de vapor, l’energia hidroelèctrica, la realització de reserves de distribució d’aigua, la realització d’aparells depuradors d’aigua i la possibilitat de recirculació d’aigües són fets que han donat noves dimensions a aquest paper. Les indústries més grans consumidores d’aigua són les siderúrgiques, les centrals tèrmiques, les fàbriques de pasta de paper, les petroquímiques, les d’acabats tèxtils i les alimentàries. La seva localització crea problemes quant a l’alimentació d’aigua, importants pel volum exigit, però també per la seva qualitat (per exemple, en la indústria de paper). Determinades indústries, com les centrals o les siderúrgiques, necessiten la presència d’un curs d’aigua abundant. En aquests casos, on la major part de l’aigua només serveix com a agent tèrmic per a refredar, la tècnica actual permet, gràcies a refrigeradors, d’aprofitar i tornar a utilitzar més d’un 90% del total d’aigua en circulació (recirculació). La utilització de circuits tancats de refrigeració molt sovint es justifica, tot i disposar de cabals suficients d’aigua, pel fet que resulta més econòmic que el bombeig, si l’aigua és de pous profunds, o que la depuració (sedimentació i filtració) del ple cabal, si són aigües fluvials habitualment tèrboles. En tractar només l’aigua d’aportació (pèrdues i purgues de desconcentració de sal) és possible, en la mateixa instal·lació, de clarificar la i millorar-la químicament per evitar incrustacions o corrosions. Les indústries que més pol·lueixen l’aigua (papereres, acabats tèxtils, adoberies, etc), per tal com l’empren principalment per a rentar o esbandir, són les més directament afectades per la creixent necessitat d’aigua. Principalment els és costós de recuperar aigües, pels subproductes que porten (detergents, colorants), ja que les plantes de tractament són molt costoses en inversió i manteniment. Malgrat tot, cada vegada més, hom cerca almenys d’aprofitar aigües de segons rentats que, menys carregades, puguin ésser condicionades amb un cost mínim. D’altra banda, la vigilància dels llits fluvials, cada vegada més seriosament aplicada per part de les autoritats competents, força aquests tipus d’indústria a vessar aigües pol·luïdes sota especials condicions, més o menys severes segons la proximitat, aigües avall, de nuclis d’altres consumidors ( aigües residuals). Aquest és un factor politicoadministratiu que se superposa al de la disponibilitat d’aigües i que pot ésser determinant en la localització de la indústria. En aquelles indústries on l’aigua és incorporada al producte fabricat (begudes, laboratoris farmacèutics, etc) les condicions de qualitat i potabilitat de l’aigua han d’ésser definitives ( aigua potable). Són però, molt sovint, la proximitat d’un centre consumidor i el cost dels transports factors més decisius que el cost de la depuració de l’aigua per a la localització de la indústria. El paper de l’aigua com a font d’energia és també remarcable. Inicialment foren les rodes hidràuliques els elements motrius de la indústria, fet que explica, per exemple, la presència de la indústria paperera de la conca de l’Anoia i la de les indústries tèxtils als cursos alts del Llobregat, del Freser i del Ter, zones on s’assentaren nuclis industrials importants que, abans de la introducció del vapor com a font i transport d’energia, trobaren en l’aigua dels rius la substitució i la superació de l’esforç humà. Encara actualment la utilització de turbines hidràuliques permet a certes indústries d’aprofitar les condicions geogràfiques d’algunes zones. La combinació de cabals grans d’aigua amb una geografia que faciliti la construcció de rescloses (“hulla blanca”) ha tingut un paper decisiu en l’avenç del desenvolupament industrial d’uns països respecte a d’altres. Quant a l’aigua com a via de comunicació, és en la mar que cal pensar primàriament. El fet que el petroli i els seus derivats hagin desplaçat els combustibles sòlids (carbó i llenya) ha obligat les indústries pesades a situar-se en zones costaneres, per la facilitat de rebre i expedir la matèria primera i els productes elaborats. La importància d’aquest capítol ens la donen les grans obres realitzades per millorar les comunicacions entre les grans mars i els oceans: canals de Suez, Panamà i Kiel. També els grans cursos de navegació interior continuen essent, com fou el Nil per a Egipte, l’espina dorsal de zones fortament industrialitzades. En són clars exemples la conca del Rin, la xarxa de canals artificials dels Països Baixos, els rius fusterers del Canadà i de Suècia, el Volga a l’URSS, etc., que a part aprofitar normalment l’aigua permeten de disposar d’un medi de comunicació essencialment econòmic.
L’aigua i l’economia
Les característiques de l’oferta i la demanda de l’aigua són més complexes que no les de la majoria de béns, a causa, sobretot, dels usos tan diferents i de la valoració difícil d’aquests usos. Els augments del consum per habitant, el creixement de la població i l’increment de la urbanització han fet que el problema de l’escassetat d’aigua sigui general. El consum d’aigua és en relació directa amb el desenvolupament i l’estructura de l’economia. A les zones agrícoles dels països subdesenvolupats aquest consum és d’uns 40 l/h/dia, mentre que a la ciutat de Chicago és de prop de 1.000 l/h/dia. L’ús, tenint en compte el cicle de l’aigua, cal que sigui valorat segons quatre factors: la quantitat presa, la qualitat en aquell moment, la quantitat i la qualitat de la residual, ja que, segons el grau de pol·lució, l’aigua residual no pot ésser emprada en la majoria dels usos. Quantitativament l’ús més important és l’agrícola, on té una funció insubstituïble. La indústria empra l’aigua com a primera matèria, però també i principalment per tal de refrigerar o de netejar en alguna fase del procés productiu. Cada sector i fins i tot cada tipus d’instal·lació té un consum diferent, però poden ésser indicades com a branques de fort consum la indústria alimentària, la siderúrgia, les refineries petrolíferes, certes branques de la indústria química i les centrals d’energia elèctrica convencionals o nuclears. Per les seves característiques especials és important el sector hidroelèctric, el consum del qual no requereix cap factor qualitatiu de l’aigua, però en establir el desnivell necessari per a produir l’energia, actua sobre tota una sèrie de factors. Produeix una regulació en el cabal dels rius, per tal com evita les crescudes i permet un abastament regular tot al llarg de l’any dels diferents usuaris: agrícoles, industrials o urbans. Les dificultats d’establir un criteri de cost-benefici en aquest tipus d’inversions pot donar una idea de les dificultats de valoració de l’aigua com a recurs productiu. Aquest fet i el de les grans economies d’escala que es produeixen en la seva explotació, juntament amb el fet d’ésser un bé bàsic, té dos efectes: en primer lloc, que la seva explotació sigui feta mitjançant monopolis, i en segon lloc, que aquests monopolis tinguin caràcter públic o semipúblic i que la relació entre la utilitat del recurs i el seu preu sigui escassa. Generalment el preu de l’aigua és de tipus anomenat polític. L’ús més important en relació amb els problemes que origina és sens dubte l’urbà. Les necessitats són encara molt elevades malgrat l’increment de l’abastament. Dels 600 milions d’habitants de les zones urbanes dels països subdesenvolupats, el 30% no tenen aigua corrent. A més de les grans necessitats que creen, les aglomeracions urbanes produeixen una gran pol·lució de les aigües. Juntament amb l’aigua contaminada, una ciutat d’un milió d’habitants llença a les clavegueres uns 1.000 m3 de fangs. Els augments de consum previstos a tot el món (es calcula que del 1980 a l’any 2000 l’increment de consums serà de l’ordre de 2,5 vegades l’actual) produiran un encariment del recurs i obligaran a una racionalització de consums, al bandejament de tècniques d’irrigació dispendioses i a un cert retorn a l’agricultura de secà.
Legislació de l’aprofitament de les aigües
Les lleis regulen diverses qüestions referents a les aigües, tals com la propietat, l’aprofitament, servituds que hi tenen relació, etc. Les aigües que cauen o neixen en un predi particular són del domini privat del propietari d’aquest predi mentre hi corren; en sortir del predi on han nascut o han caigut, les aigües que corren són ja del domini públic, tant si corren amb continuïtat (rius) com amb discontinuïtat (rieres). Són del domini públic des de llur origen les aigües que cauen o neixen en terrenys de domini públic. Les aigües estancades que formen llacs o llacunes i les subterrànies són de domini privat o de domini públic segons que sigui de propietat privada o pública el terreny on es troben. Solament el propietari pot fer aixecar les aigües subterrànies d’un predi, construir pous, mines, etc., i només ell pot aprofitar les aigües així obtingudes i les de pluja, mentre les unes i les altres corrin per la seva propietat. Les aigües públiques (rius, rierols, llacs, etc.) poden ésser utilitzades i aprofitades per tothom, sempre que es tracti d’un ús normal i no privatiu (banyar-se, pescar, beure, navegar, etc.) i no hi hagi una prohibició o reglamentació especial; el dret a un ús especial o privatiu d’aigües públiques (regadiu, aprofitament elèctric o industrial, etc.) dóna lloc a l’anomenat aprofitament d’aigües, que atorga l’administració pública per una concessió administrativa; aquests drets també poden adquirir-se per prescripció de vint anys. De tota manera cal tenir presentque un projecte de llei en tràmit modifica substancialment tota aquesta normativa legal, no sols pel que fa a l’actual llei d’aigües que deroga, sinó també pel que fa a les disposicions que conté el Codi Civil sobre aquesta matèria. Aquest projecte de llei considera les aigües continentals superficials o subterrànies com un bé de domini públic estatal i, si bé respecta els drets adquirits inscrits, nega tota possibilitat d’adquisició de domini en el futur per via de prescripció. Els predis inferiors són sotmesos a una servitud legal d’aigües, que obliga el propietari a rebre les aigües que naturalment baixen pel predi superior, siguin contínues o discontínues, sense que puguin fer res per a impedir-ho. També hi ha d’altres servituds legals o voluntàries que tenen per objecte el pas de conduccions d’aigües per predis aliens (servitud d’aqüeducte), l’ús d’aigua d’altri per a abeurar el bestiar (servitud d’abeurador), el lliure pas per la vora dels rius per a les necessitats de la navegació, de la pesca, etc. L’abastament d’aigües a les poblacions gaudeix d’una protecció legal, i per aquest motiu pot ésser imposat l’aprofitament forçós de les aigües privades mitjançant indemnització. L’aprofitament de les aigües per al reg de camps pot donar lloc a la constitució de sindicats de regants i altres institucions similars, algunes d’elles de gran prestigi històric, com el Tribunal de les Aigües de València. L’administració pública té al seu càrrec el control sobre aprofitament, utilització i seguretat pública de les aigües, etc., i a Espanya aquestes funcions corresponen principalment als ministeris d’obres públiques, governació, indústria i agricultura. En canvi, corresponen als tribunals de justícia les qüestions sobre propietat i domini de les aigües, danys i preferències en els drets d’aprofitament.