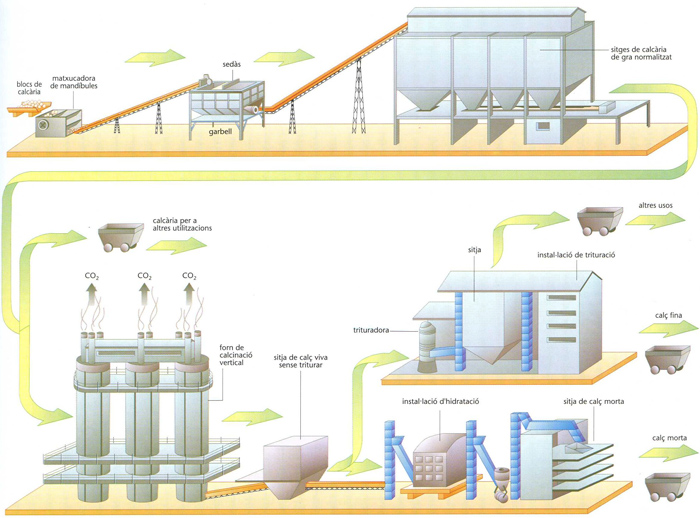
Precisament en la producció de calç és consumida la major quantitat de calcària. Industrialment, l’obtenció de calç és efectuada sovint en forns verticals. Per a grans produccions d’alguns centenars de tones diàries, hom empra forns rotatoris semblants als emprats en la fabricació de ciment, bé que consumeixen més combustible i tenen més exigències quant a la natura i la granulometria de la calcària emprada que els altres forns de calç. La calç és un sòlid blanc, d’un punt de fusió molt elevat (uns 2.600°C) i que es volatilitza al forn elèctric; té una gran afinitat per l’aigua, que la transforma en hidròxid tot desprenent una gran quantitat de calor. És emprada en construcció per a la preparació del morter. Hom l’empra, també, per a preparar bases alcalines, carbur de calci, vidre i clorur de calç, per a depurar aigües dures, en adoberia per a depilar pells, en agricultura per a neutralitzar els sòls àcids, i, per raó del seu alt punt de fusió, com a material refractari en els recobriments de forns d’altes temperatures. És anomenada també calç viva, per oposició a calç morta.
f
Construcció i obres públiques
Química