A diferència de les reaccions tèrmiques que transcorren entre molècules en llurs estats electrònics fonamentals (tot i que llurs energies de vibració, de rotació i de translació són en els marges alts d’una distribució de Maxwell-Boltzman), les reaccions fotoquímiques tenen lloc en molècules en llurs estats electrònics excitats, que són obtinguts per absorció d’un fotó. En fotoquímica interessen els fotons de longitud d’ona (λ) entre 200 i 800 nm, per dues raons: en primer lloc, perquè el contingut energètic d’aquests fotons equival a la diferència d’energies que hi ha entre l’últim orbital ocupat i els primers no ocupats de la major part de molècules; per tant, llur absorció promou un electró i fa variar l’estat electrònic de la molècula, al qual hom arriba en un nivell vibracional excitat (principi de Franck-Condon); i en segon lloc, perquè aquest marge de λ constitueix la irradiació més corrent: fonts lluminoses de mercuri i la radiació solar. El procés d’absorció té lloc sempre que la separació energètica entre l’estat fonamental i l’estat excitat coincideixi amb l’energia del fotó, és a dir:
E e s t a t f i n a l — E e s t a t i n i c i a l = hc/ λ,
c essent la velocitat de la llum i h la constant de Planck. A més del requeriment energètic, l’absorció té efecte amb conservació del spin total de la molècula, és a dir, si es parteix d’un estat fonamental singlet (S 0 ), que és el més general, l’estat excitat d’arribada també serà un singlet (S 1 , S 2 , etc). No obstant això, moltes molècules, després de l’acte d’absorció, poden invertir el spin de l’electró, després de relaxar-se vibratòriament, i passen a un estat electrònic triplet (T) d’energia lleugerament inferior al singlet corresponent. Les reaccions fotoquímiques en fase condensada tenen lloc generalment a partir dels estats excitats S 1 i T 1 . D’aquí la molècula, a causa de l’excés energètic que posseeix, pot experimentar un canvi químic que competeix, malgrat tot, amb processos fotofísics. En efecte, la molècula excitada pot emetre radiació electromagnètica des de l’estat S 1 (fluorescència), desactivant-se a l’estat fonamental:
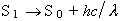
La vida mitjana de l’estat S 1 enfront del procés d’emissió és de 10 - 8 a 10 - 6 s. També pot emetre des de l’estat T 1 (fosforescència):
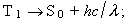
en aquest cas, puix que cal invertir el spin electrònic, el procés és molt més lent. La vida mitjana de l’estat T 1 és de 10 - 3 s; és a dir, els estats triplet tenen molta més durada que els estats singlet i, doncs, la probabilitat que s’hi esdevingui un canvi químic és molt més gran. L’eficiència d’un fotoprocés és expressada en termes del rendiment quàntic, ϕ, que defineix per l’expressió següent:
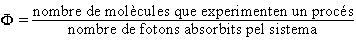
El nombre de fotons absorbits pel sistema pot ésser determinat mitjançant actinòmetres (físics, com el sistema de termopiles o els fotomultiplicadors, i químics, com el de ferrioxalat potàssic). Atès que moltes molècules no aconsegueixen fàcilment, per simple irradiació, l’estat triplet, cal emprar fotosensibilitzadors perquè la molècula experimenti una reacció fotoquímica. Els fotosensibilitzadors (D) són substàncies que aconsegueixen amb facilitat l’estat triplet i després són capaces de transferir l’energia electrònica a la molècula acceptora (A), que resta excitada en l’estat triplet:
D T 1 + A S 0 →D S 0 + A T 1
Un fotosensibilitzador ben conegut és la clorofil·la , que actua en el procés de fotosíntesi en les plantes verdes. Moltes reaccions químiques són possibles per irradiació. Algunes tenen lloc amb fissió d’enllaç (fotòlisi), bé que d’altres produeixen isomeritzacions o formen nous enllaços (fotociclacions, fotocicloaddicions, etc). La fotoisomerització de dobles enllaços carboni-carboni té implicacions biològiques, puix que l’acte de la visió s’inicia amb la fotoisomerització del cis -retinal a trans -retinal.