És un gas incolor, inodor i insípid, i és l’element més lleuger del grup. Fou descobert per D.Rutherford el 1772, i a la mateixa època, també per H.Cavendish i J.Priestley. El nitrogen natural és format pels isòtops naturals 14N i 15N i pels isòtops radioactius 12N, 13N, 16N i 17N. En estat natural el nitrogen molecular, a la temperatura ambient, és un gas que constitueix una gran part de l’atmosfera; l’aire sec en conté un 78,09% en volum. En estat combinat és un dels principals constituents de les proteïnes animals i vegetals i d’un gran nombre de substàncies orgàniques. El nitrat de Xile és el principal mineral que conté nitrogen combinat. L’estructura electronicomolecular del nitrogen és [N≡LN], on presenta un triple enllaç covalent.
Estudis espectroscòpics indiquen que, a la temperatura ambient, N2 comporta molècules amb spins nuclears paral·lels i antiparal·lels, que són en una relació 2/1. El nitrogen pot tenir els nombres d’oxidació -3, +3 i +5, i forma hidrurs de fórmula MH3, òxids de fórmula M2O3 i M2O5 i halurs MX3. El nitrogen es diferencia dels elements del seu grup per tres caràcters importants: en primer lloc, no pot tenir més de vuit electrons en el seu embolcall extern, i per tant no pot formar més de quatre enllaços dirigits seguint l’orbital s i tres orbitals p. En segon lloc, el nitrogen forma fàcilment dobles i triples enllaços, mentre que en el cas dels altres membres de la família, la tendència és menys clara; és per aquesta raó que els dobles enllaços sovintegen en la química del nitrogen. I, en tercer lloc, la petita dimensió de l’àtom de nitrogen limita el seu nombre de coordinació, per impediment estèric. Els canvis de fase són determinats pel nitrogen molecular a la pressió atmosfèrica:
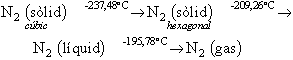
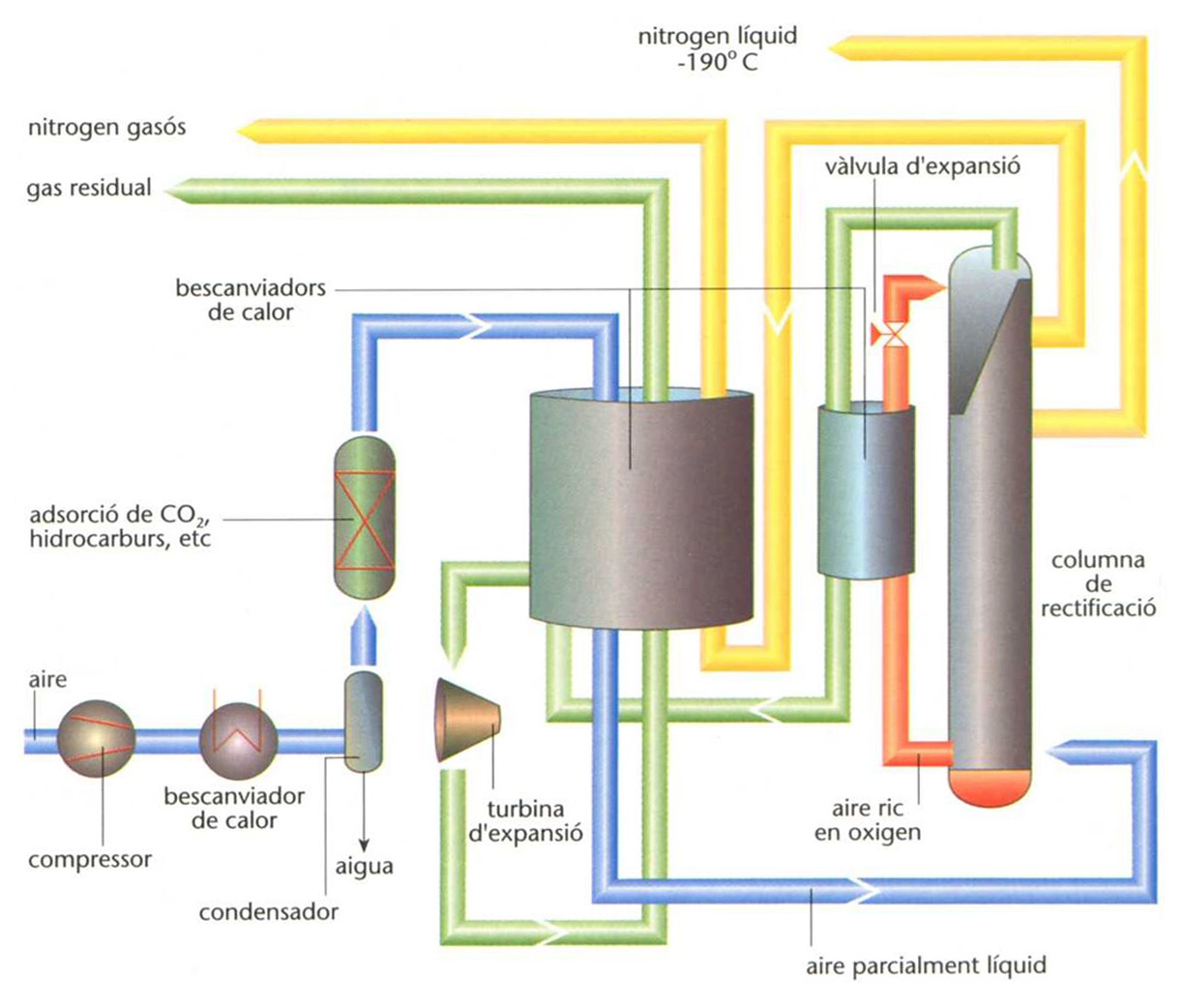
Hom obté el nitrogen en el laboratori mitjançant la reacció NaNO2 + NH4Cl →N2↑+ NaCl + 2H2O, i també per oxidació de l’amoníac (NH3 + HNO2 →2H2O + N2 ↑) o per descomposició del nitrur sòdic (2NaN3 →2Na+3N2). Industrialment, hom l’obté per destil·lació fraccionada a baixa temperatura de l’aire líquid. El nitrogen elemental no reacciona a la temperatura ambient amb la majoria de les substàncies; a alta temperatura, la forma molecular reacciona amb metalls com el crom, el silici, el titati, l’alumini, el bor, el beril·li, el magnesi, el bari, l’estronci, el calci i el liti, i forma nitrurs, segons la reacció 3Ca+N2 →Ca3N2. Amb l’oxigen, a alta temperatura (2 000 a 3 000°C), forma NO; amb l’hidrogen, a baixa temperatura i a alta pressió, en presència de catalitzadors, forma l’amoníac. Per sota de 1 800°C, N2, C i H2 es combinen entre ells i formen l’àcid cianhídric. Atès que el nitrogen és poc reactiu, hom empra el nitrogen activat, molt més reactiu, el qual dóna les reaccions següents, en què el nitrogen activat és marcat amb un asterisc:
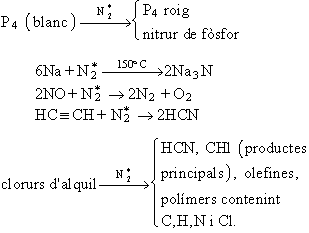
S'han realitzat experiments amb nitrogen molecular a elevada pressió amb el resultat que, per sobre de 150 GPa, la molècula es trenca i forma nitrogen atòmic. Aquest sembla tenir propietats interessants a altes pressions: es torna opac i adquireix característiques semiconductores. A pressions més elevades pot solidificar en forma metàl·lica.El nitrogen en estat pur és molt emprat com a matèria base per a la preparació de composts, com l’amoníac, les sals d’amoni, l’àcid nítric i els nitrats, la urea i la cianamida càlcica; les propietats criogèniques són emprades en la conservació d’aliments congelats, i també en medicina, gràcies a la possibilitat de conservar òrgans enters durant un llarg període de temps.
Propietats físiques del nitrogen
| nombre atòmic | 7 |
| pes atòmic | 14,007 |
| estructura electrònica | [He] 2s22p3 |
| estats d’oxidació | +3, +5, -3 |
| densitat | 0,81 g/ml |
| punt de fusió | -209,86ºC |
| punt d’ebullició | -195,80ºC |
| radi iònic (N+) | 0,25 Å |
| temperatura crítica | -141,7ºC |
| pressió crítica | 33,5 atm |
| potencial d’ionització, en eV | I: 14,534 |
| II: 29,601 | |
| III: 47,448 |