Fou descobert l’any 1817 per J.J.Berzelius en intentar una síntesi de l’àcid sulfúric. El seleni natural és constituït per una mescla de sis isòtops naturals estables amb masses que van de 74 a 82 i que determinen un pes atòmic de 78,96. Són també coneguts 14 radioisòtops artificials de l’element. És un element rar, que constitueix el 10-4 per cent del pes de l’escorça terrestre. Ocorre rarament natiu, associat amb el sofre, i els seus minerals més importants són alguns selenurs (PbSe, Ag₂Se). També es troba, en petita proporció, associat amb les menes del coure, níquel i plom, de les quals hom el recupera com a subproducte. Hom l’obté principalment del fang anòdic del refinatge electrolític del coure, i és purificat per transformació en el diòxid (SeO₂), sublimació d’aquest i posterior reducció. El seleni pot existir en tres formes al·lotròpiques, la més estable de les quals és hexagonal i presenta caràcter metàl·lic i conducció elèctrica. El seleni amorf, que presenta característiques similars a les del sofre, s’estova per escalfament suau i esdevé plàstic a 70°C. Entre les propietats físiques de l’element cal esmentar la fotoconducció i l’augment de la seva resistència elèctrica amb la temperatura.
El descobriment d’aquestes propietats, fet per W.Smith l’any 1873, permeté el desenvolupament de la cel·la fotoelèctrica i marcà l’inici de la importància econòmica del seleni. Exhibeix, d’altra part, conducció unipolar, que permet la rectificació de corrents alterns. Des del punt de vista químic, la reactivitat del seleni és similar a la del sofre, tot i que atenuada. S'uneix directament a l’hidrogen, oxigen, nitrogen i halògens, així com a la majoria de metalls. És atacat fàcilment pels àcids sulfúric i nítric concentrats, amb formació del diòxid (SeO₂), i es dissol en els àlcalis concentrats. Pot actuar en els seus composts amb les valències 2 (en els selenurs), 4 (en els selenits, derivats halogenats, oxihalogenurs i en el diòxid) i 6 (en el triòxid i en els selenats). Les aplicacions més importants del seleni són: en electrònica, per a la fabricació de cel·les fotoelèctriques i rectificadors de corrent, en la indústria del vidre, per a donar color de robí, i en metal·lúrgia, com a additiu de l’acer per a millorar les seves propietats mecàniques. D’altra part, i cada vegada més, el seleni troba aplicació en química orgànica. Tant el seleni com els seus composts són altament tòxics, tant per via oral com per via pulmonar o cutània. Alternativament, en dosis molt petites gaudeixen de propietats terapèutiques.
Composts orgànics del seleni
El desenvolupament de la química orgànica del seleni és un fet recent que començà d’adquirir importància a partir dels anys cinquanta; anteriorment, el seleni havia constituït únicament un problema per als químics orgànics a causa de les interferències que produïa en la determinació analítica de carboni i hidrogen. L’observació de la seva toxicitat i de l’activitat biològica d’alguns dels seus composts, a dosis molt petites, foren possiblement els trets més destacats que endegaren una recerca sistemàtica en aquest camp. Des d’un punt de vista general, els composts de seleni són més reactius que els corresponents de sofre, especialment en processos d’oxidoreducció, i, igualment, l’enllaç C-Se és menys estable que el C-S, principalment a causa de la diferència de grandària entre els dos elements i la similitud de llurs electronegativitats. Com a conseqüència de la feblesa de l’enllaç C-Se, els composts de seleni, en presència de llum, mostren sovint color vermell, originat per la presència de l’element lliure. En l’actualitat són coneguts un gran nombre de composts orgànics del seleni, pertanyents a gairebé totes les categories anàlogues a les d’oxigen i sofre; és a dir, selenols (R-SeH),
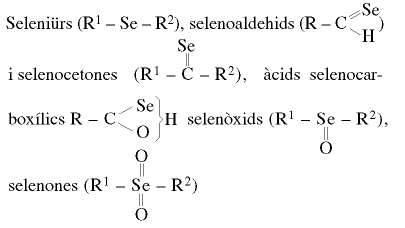
etc, a més d'una varietat d'estructures heterocícliques que contenen l'element. Ultra l'interès que molts d'aquests composts presenten en síntesi orgànica, és també important l'estudi de la possible substitució de sobre per seleni en sistemes biològics. La recerca en química orgànica i biològica del seleni és basada en l'ús d'isòtop 27Se com a traçador, en la identificació dels seus conjunts isotòpics per espectrometria de masses, en l’aplicació de l’isòtop 2 5Se en ressonància magnètica nuclear i en les diverses absorcions característiques dels grups funcionals del seleni en les espectroscòpies d’infraroig, ultraviolada i visible.
Propietats físiques del seleni
| nombre atòmic | 34 |
| pes atòmic | 78,96 |
| estructura electrònica | [Ar] 3d104s2p4 |
| estats d’oxidació | -2, +4, +6 |
| densitat | 4,79 g/ml |
| punt de fusió | 217ºC |
| punt d’ebullició | 684,9ºC |
| radi iònic (Se+) | 0,66 Å |
| potencials d’ionització, en eV | I: 9,752 |
| II: 21,19 | |
| conductivitat tèrmica (seleni amorf) (a 25ºC) | 0,00519 W/cm∙K |
| resistivitat elèctrica (a 0ºC) | 106 μΩ∙cm |