Resultats de la cerca
Es mostren 5 resultats
Aleksandr Mikhailovič Butlerov
Química
Químic rus, deixeble de Charles Wurtz, professor de química orgànica a Kazan’.
Definí el concepte de l’estructura química, el qual permeté d’arribar al concepte d’isomeria L’aplicació d’aquests principis el portà a descobrir els alcohols terciaris
Joseph Black
Química
Químic escocès.
Fou professor de química i medicina a les universitats d’Edimburg i de Glasgow En les seves investigacions identificà el diòxid de carboni com un gas distint de l’aire aire fix Aquest descobriment li permeté més endavant d’establir la diferència entre òxids i carbonats Els seus treballs s’estengueren a l’estudi dels bescanvis de calor que s’esdevenen en els canvis d’estat definí la calor de canvi d’estat i la calor específica
base
Química
Cadascuna de les substàncies caracteritzades químicament per les següents propietats:.
provocar el canvi de color o el viratge de determinades substàncies orgàniques, anomenades indicadors , o bé regenerar llur color primitiu quan aquest ha estat alterat prèviament pels àcids, i donar amb els àcids reaccions de neutralització en què es perden les propietats característiques d’ambdues classes de substàncies i es formen sals Trets organolèptics menys generals de les bases són llur sabor amarg i llur tacte untuós El concepte de base s’ha desenvolupat parallelament al d' àcid La primera teoria moderna que intentà de relacionar les propietats àcides o bàsiques amb la…
pH
Química
Concepte introduït el 1909 per S.P.L.Sorensen per donar una mesura quantitativa de l’acidesa o basicitat d’una dissolució.
Sorensen definí el pH d’una dissolució com el logaritme decimal canviat de signe de la concentració d’ions hidrogen pH = -log H + , i posà a punt un mètode electromètric per a determinar-lo Tot i que aquest mètode ha restat com a definitiu, el concepte primitiu de pH ha sofert diverses transformacions Actualment, el pH és definit d’una manera operativa, segons l’equació pH x - pH r = E x -E r / k , en la qual pH x és el pH de la dissolució desconeguda, pH r el de la dissolució de referència, E x la força electromotriu de la cella H 2 1 atm/dissolució x || elèctrode de referència…
àcid
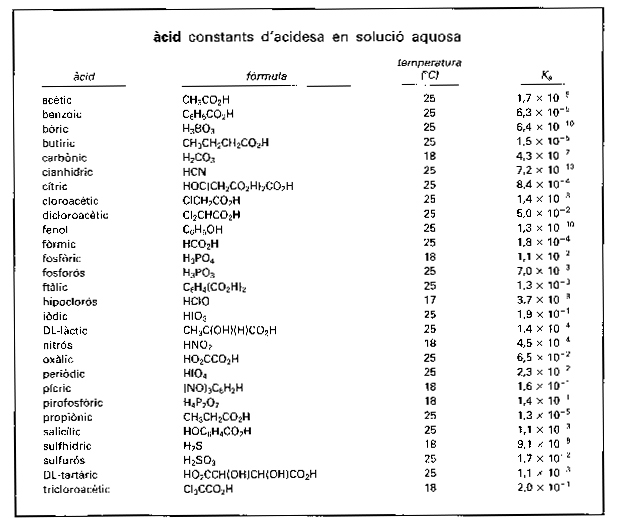
Constants d’acidesa en solució aquosa
Química
Cada una de les substàncies caracteritzades químicament pel fet de provocar canvis de color en les substàncies anomenades indicadors i de reaccionar molt ràpidament amb les substàncies d’un altre grup anomenades bases.
Les propietats típiques d’ambdós reactius desapareixen pel fet de la reacció, cosa que és interpretada com una neutralització mútua dels àcids i de les bases que dóna composts neutres tals com, per exemple, les sals Aquestes dues propietats essencials van acompanyades, en general, d’altres de menys fonamentals i no sempre presents, com el sabor àcid, l’activitat catalítica i la propietat —en solució aquosa— de dissoldre certes substàncies insolubles com els carbonats i molts metalls A més, els àcids i les bases poden desplaçar-se mútuament de llurs composts correlativament a llurs forces El…