Resultats de la cerca
Es mostren 8 resultats
calor de reacció
Química
Energia tèrmica alliberada o absorbida en qualsevol procés químic.
Quan aquest és dut a terme a pressió constant, l’esmentada energia coincideix amb la que en termodinàmica rep el nom d' entalpia , i quan ho és a volum constant, amb l’anomenada energia interna Segons la natura del procés, la calor de reacció té expressions pròpies Així, la calor de formació d’un compost és l’increment d’entalpia que tindrà lloc quan un mol d’aquest és format teòricament a partir dels seus elements considerats en l’estat tipus, a una pressió i una temperatura determinades la calor de combustió , quan és cremat completament un mol, a una temperatura determinada i a la pressió…
acidesa
Química
Indicació quantitativa de les propietats àcides.
L’acidesa d’un àcid HA en un solvent amfipròtic S, o sigui, la seva força en aquest solvent, ve mesurada per la seva tendència a cedir un protó al solvent, és a dir, per la constant d’acidesa K A expressió on a i és l’activitat de l’espècie i i K és la constant de l’equilibri HA + S ⇌ HS + + A - La força d’un àcid depèn, doncs, del solvent En general, resulta còmode d’expressar l’acidesa en unitats logarítmiques, i per obtenir nombres positius hom pren el logaritme de la inversa de K A , que és representat pel símbol pK A pK A = - log K A Com més elevada és l’acidesa, és a dir, com més…
anàlisi conductomètrica
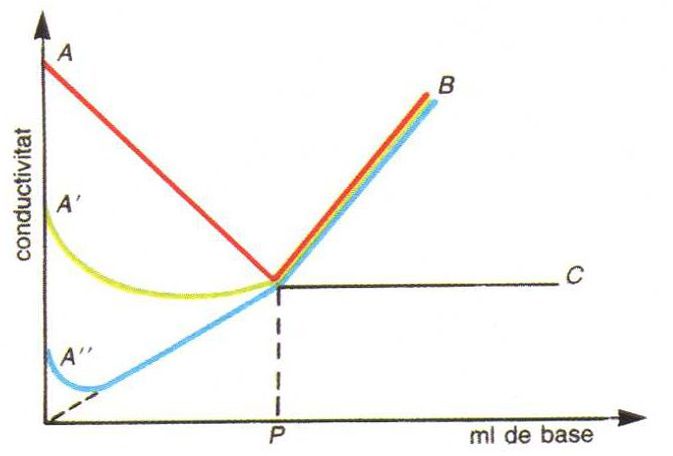
Valoració conductomètrica d’un àcid amb una base: corba AB, àcid fort amb una base forta; corba A'B, àcid mitjanament fort amb una base forta; corba A''B àcid feble amb una base feble; P, punt d’equivalència
©
Química
Procediment analític usat per a determinar el punt final de les volumetries, basat en la mesura de la variació de la conductivitat electrolítica de la solució problema deguda a l’addició de reactiu valorant.
Com que la conductivitat electrolítica depèn de la mobilitat dels ions presents en la solució i de llurs concentracions, l’addició d’un reactiu en provoca canvis importants sempre que doni lloc a la desaparició d’una espècie iònica de la solució sigui per formació d’un compost poc dissociat o d’una sal insoluble i a la seva substitució per quantitats equivalents d’un dels ions del reactiu de mobilitat diferent de la de l’espècie eliminada Així, hom pot dur a terme conductimètricament volumetries de neutralització, de precipitació i de formació de complexos, però només en casos…
tensioactiu catiònic
Química
Compost tensioactiu que, dissociat en solució aquosa, té la major part de l’activitat superficial de la molècula en el catió.
tensioactiu aniònic
Química
Compost tensioactiu dissociat en solució aquosa, en el qual la part de major activitat superficial de la molècula es troba en l’anió.
solució
Química
Mescla en la qual els components són distribuïts homogèniament en tota l’extensió del sistema.
En els sistemes binaris, hom acostuma a denominar solut el component minoritari, i dissolvent el majoritari, classificació que pot ésser estesa als sistemes de més components D’acord amb l’estat físic en què ocorren, hom sol distingir les solucions sòlides, les líquides i les gasoses Les solucions sòlides es formen mitjançant la interpenetració de les xarxes cristallines dels components, i llur formació exigeix no solament l’existència de forces atractives entre aquests, sinó també estructures cristallines idèntiques, cosa que ocorre principalment entre els sòlids que originen cristalls molt…
amoníac

Propietats físiques de l’amoníac
©
Química
Gas incolor, més lleuger que l’aire, compost de nitrogen i hidrogen.
L’amoníac té una olor pungent característica i irrita els ulls i les vies respiratòries El llindar de percepció se situa a 0,04 g/m 3 53 ppm i la màxima concentració tolerable és de 0,3%o en volum a 4-5%₀ esdevé mortal En la natura, l’amoníac es forma en la descomposició de la matèria orgànica nitrogenada i hom el troba, en petita quantitat, a l’atmosfera i en moltes aigües naturals La solució aquosa d’amoníac era ja coneguda dels alquimistes al segle XV Priestley l’aïllà a l’estat gasós el 1774 i Berthollet establí la seva composició el 1785 La molècula d’amoníac és piramidal, amb el…
àcid
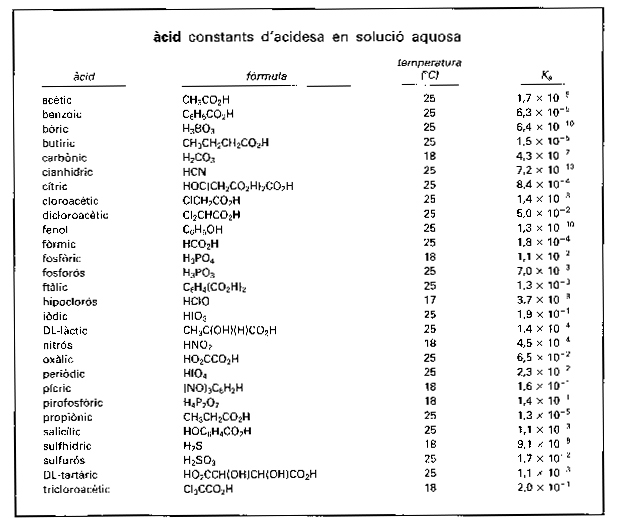
Constants d’acidesa en solució aquosa
Química
Cada una de les substàncies caracteritzades químicament pel fet de provocar canvis de color en les substàncies anomenades indicadors i de reaccionar molt ràpidament amb les substàncies d’un altre grup anomenades bases.
Les propietats típiques d’ambdós reactius desapareixen pel fet de la reacció, cosa que és interpretada com una neutralització mútua dels àcids i de les bases que dóna composts neutres tals com, per exemple, les sals Aquestes dues propietats essencials van acompanyades, en general, d’altres de menys fonamentals i no sempre presents, com el sabor àcid, l’activitat catalítica i la propietat —en solució aquosa— de dissoldre certes substàncies insolubles com els carbonats i molts metalls A més, els àcids i les bases poden desplaçar-se mútuament de llurs composts correlativament a llurs forces El…