Resultats de la cerca
Es mostren 22 resultats
pila
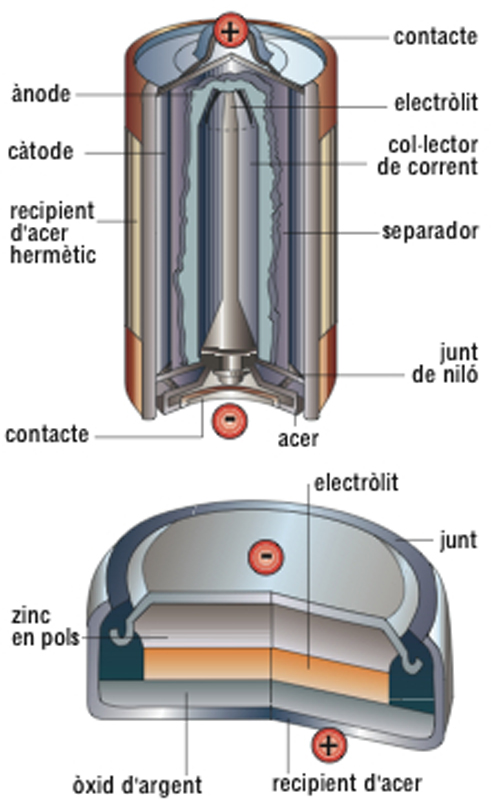
Esquemes d’una pila alcalina (a dalt) i d’una de botó d’òxid d’argent (a baix)
© Fototeca.cat
Química
Generador electroquímic que produeix una tensió contínua per acció d’una reacció química ( cel·la electroquímica
), tensió que va decreixent a mesura que la pila es va consumint.
És anomenada també pila elèctrica, pila galvànica o pila voltaica Essencialment es compon d’un electròlit i dos elèctrodes positiu i negatiu, que constitueixen un parell voltaic a més, hi ha el despolaritzador La primitiva pila de Volta 1793 era formada per una sèrie de discs de coure i zinc disposats alternativament i entre els quals hi havia unes peces de cartó o drap amarades d’àcid sulfúric Aquesta pila presentava l’inconvenient de polaritzar-se, i per això les posteriors modificacions introduïdes donaren lloc a diversos tipus de piles en les quals hom disposava un despolaritzador El…
pila patró
Química
Pila concebuda per a fornir una tensió extraordinàriament constant i destinada a ésser emprada com a patró de fem (tensió de referència).
És una pila impolaritzable, però no pot fornir sinó corrents molt febles i curts La més coneguda és la de Weston , constituïda per una amalgama de cadmi pol negatiu i mercuri pol positiu amb sulfat de cadmi com a electròlit i sulfat de mercuri com a despolaritzador La fem, d’1,0183 V a 20ºC, es manté absolutament constant També hi ha la pila de Clark , lleugerament diferent, que utilitza zinc és anterior a la de Weston i actualment poc utilitzada
pila de Weston
Química
Pila patró l’elèctrode positiu de la qual consisteix en mercuri revestit de sulfat de mercuri (I) sòlid, i l’elèctrode negatiu és una amalgama de cadmi al 12,5%.
L’electròlit és constituït per una solució saturada de sulfat de cadmi La força electromotriu d’aquesta pila, a temperatura constant, és donada per l’expressió on t és la temperatura en graus centígrads La pila de Weston té aplicació en el calibratge de potenciòmetres
pila de combustible
Química
Pila en la qual hi ha un combustible (hidrogen, hidrocarburs) que reacciona amb un oxidant i converteix l’energia de la reacció en energia elèctrica.
El principi de les piles de combustible fou descobert per Grove i Bossel el 1839, però no fou fins al final de la dècada del 1950 que es començà a desenvolupar tecnològicament Actualment hi ha almenys sis models diferents de piles de combustible que varien en funció del tipus d’electròlit utilitzat i del rang de temperatura de treball de membrana d’intercanvi de protons 30-90ºC, alcalina 50-90ºC, d’àcid fosfòric 150-200ºC, de carbonat fos 650ºC, d’òxid sòlid 800-1000ºC i, finalment, de metanol directa Totes les piles de combustible estan compostes d’un ànode i un càtode, separats per un…
carbonera
Química
Pila de fusta tapada amb llenya verda, herba i terra, on era obtingut carbó vegetal, per carbonització de la fusta.
La combustió era iniciada per un forat o xemeneia situat al mig de la pila i era regulada obrint forats laterals que permetien una circulació limitada d’aire És anomenada també pila de carbó o sitja
mètode de compensació de Poggendorff
Química
Sistema més comunament emprat per a mesurar la força electromotriu de les piles electroquímiques.
Per portar-ho a terme, hom connecta una pila A, generalment un acumulador de força electromotriu constant i més gran que qualsevol de les que hom vulgui mesurar, a través d’un conductor uniforme BC, de gran resistència La pila X, la força electromotriu de la qual hom desitja mesurar, és connectada a B amb els pols ordenats en la mateixa direcció de la pila A i, a través d’un galvanòmetre G, a un contacte mòbil D, el qual és desplaçable al llarg de BC Hom regula la posició de D per tal que no passi corrent per G, en el qual cas la caiguda de potencial al…
polarització
Química
Fenomen que provoca que, en un electròlit, la tensió d’un elèctrode o d’un element galvànic sigui diferent quan hi ha pas de corrent o quan aquest és nul.
Té una particular importància a les piles pila, on, per efectes diversos sobretot deposició dels gasos despresos pel corrent, i especialment hidrogen a l’elèctrode positiu, disminueix la tensió útil Per a combatre-la hom incorpora a la pila el despolaritzador adequat
cel·la electroquímica
Química
Dispositiu en el qual hom aconsegueix que s’efectuï una reacció química gràcies al forniment d’energia elèctrica (en el qual cas hom l’anomena cel·la electrolítica, i l’operació en conjunt rep el nom d’electròlisi) o en el qual, inversament, es produeix energia elèctrica a partir de l’energia alliberada per una reacció química que hi té lloc espontàniament (i és anomenat aleshores pila o cèl·lula voltaica).
Consisteix en un recipient que conté un o més electròlits units per ponts salins conductors o per parets poroses, amb dos elèctrodes immergits dins el líquid i connectats entre ells a través d’un circuit exterior En la cella té lloc, en tot cas, una reacció global d’oxidoreducció a l' ànode té lloc la semireacció d’oxidació, i al càtode , la de reducció Quan la cella funciona com a recinte d’una electròlisi, hom aplica una diferència de potencial als elèctrodes, amb la polaritat positiva a l’ànode i la negativa al càtode, per tal de proporcionar a aquest elèctrode els electrons necessaris per…
semireacció
Química
En una reacció d’oxidoreducció, cadascun dels processos d’oxidació o de reducció quan hom els considera, artificiosament, per separat.
Les semireaccions són representades mitjançant equacions químiques en les quals intervenen electrons com a “reactius” en un dels dos membres, i tenen associat un potencial d’elèctrode característic L’ús de les semireaccions permet, mitjançant llur combinació apropiada, el càlcul del potencial del sistema considerat i l’estimació —fent servir l’equació de Nernst— de la constant d’equilibri del procés pila Així, en la pila Daniell semireacció d’oxidació anòdica Zn 0 →Zn 2 + +2e - , E 0 o x i d = 0,76 V semireacció de reducció catòdica Cu 2 + +2e - →Cu 0 , E 0 r e d = -…
cèl·lula voltaica
Química
cel·la electroquímica
destinada a produir energia elèctrica.
Hom l’anomena més correntment element primari o pila