El cost dels nous fàrmacs en oncologia i el seu impacte en la salut pública
-
- Home
-
- 1 of 1
Fa gairebé un any, l'Association of the British Pharmaceutical Industry va publicar el rànquing de consum de medicaments en 13 grans estats, situant Espanya en la segona posició de consum global en indicadors considerats "claus" en comparacions internacionals. Espanya només va quedar precedida per França, i se situava davant dels EUA i altres països, figurant en gairebé tots els subgrups terapèutics en posicions altes del rànquing, excepte en la categoria de nous fàrmacs oncològics. En efecte, l'accés als medicaments antitumorals, amb un cost de desenvolupament especialment alt, s'ha vist sensiblement perjudicat a Espanya per la reducció en la despesa farmacèutica (més d’un 6% en termes reals durant el 2011), seguint la reducció general en la despesa en salut observada en els últims anys. La conjuntura econòmica actual fa difícil la restauració d'un servei de qualitat a Espanya, un país on, per exemple, l’any 2011 el 73% de la despesa en salut va ser finançada per recursos públics (molt a prop de la mitjana dels països de l'OCDE), i sobretot quan els costos de desenvolupament farmacèutic (i per tant els preus dels nous medicaments) són cada vegada més elevats. Aquesta situació ha alimentat diverses polèmiques en els darrers mesos, generades pel preu de teràpies innovadores, com el tractament de l’hepatitis C amb el Sovaldi o la immunoteràpia contra el melanoma amb l'anticòs Yervoy. En aquests casos, l'opinió pública ha apuntat directament a la indústria farmacèutica per la seva política de preus. També és cert que, com en qualsevol indústria, les decisions financeres dins de la indústria farmacèutica estan necessàriament influenciades per criteris de rendibilitat econòmica, però fins a quin punt?
En aquest article pretenem donar al lector una informació global i objectiva sobre els costos associats al desenvolupament d’aquests tipus d’agents i deixar-li opinar sobre la (no)justificació de la política de preus practicada pel sector farmacèutic.
La vida d'una molècula (potencial medicament), assajos registrats: especificitat de l'oncologia
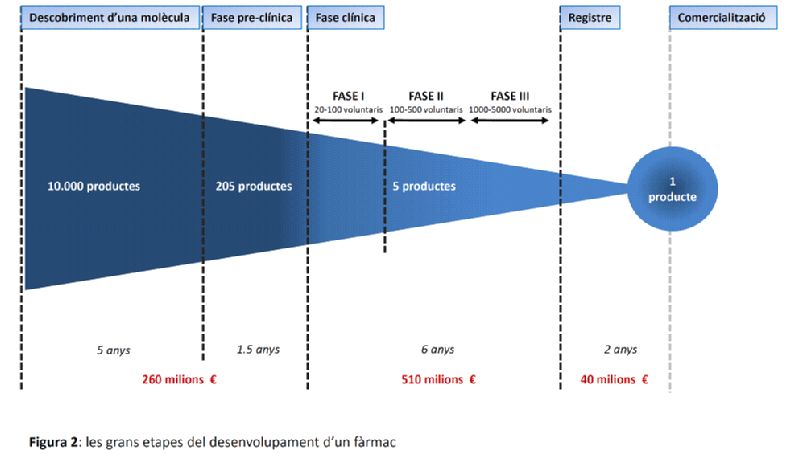
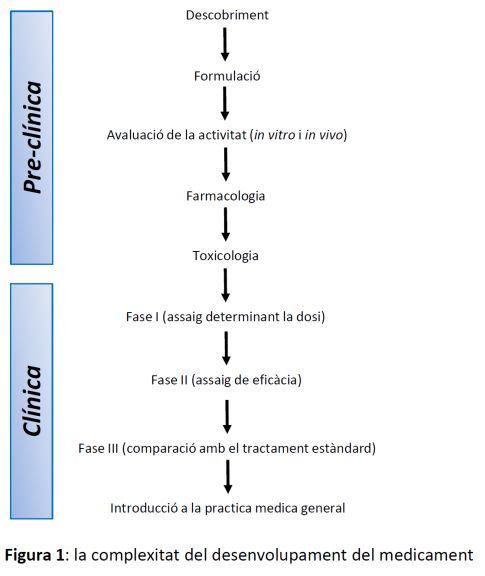 Tots els nous medicaments introduïts en el mercat són el resultat de llargs, costosos i arriscats processos d'R+D (Recerca+Desenvolupament) duts a terme per les empreses farmacèutiques. Les etapes del desenvolupament d'un medicament es descomponen en etapes preclíniques i etapes o assaigs clínics (fases 1, 2 i 3) (figura 1). Dins de les etapes preclíniques, hi trobem el descobriment de la molècula i la definició de la seva formulació, l'avaluació de la seva activitat in vitro i in vivo, els estudis farmacològics i els estudis toxicològics. Els assaigs clínics de fase 1 inclouen la determinació de la dosi terapèutica, els de fase 2 la determinació de l'eficàcia, i els de fase 3 la comparació del nou fàrmac amb el tractament estàndard. Finalment, es procedeix a la introducció de la nova droga en la pràctica mèdica general. Per aquestes raons, des de la primera síntesi de la nova substància activa fins a l'arribada al mercat d'un medicament nou, haurà transcorregut una mitjana de 14 anys.
Tots els nous medicaments introduïts en el mercat són el resultat de llargs, costosos i arriscats processos d'R+D (Recerca+Desenvolupament) duts a terme per les empreses farmacèutiques. Les etapes del desenvolupament d'un medicament es descomponen en etapes preclíniques i etapes o assaigs clínics (fases 1, 2 i 3) (figura 1). Dins de les etapes preclíniques, hi trobem el descobriment de la molècula i la definició de la seva formulació, l'avaluació de la seva activitat in vitro i in vivo, els estudis farmacològics i els estudis toxicològics. Els assaigs clínics de fase 1 inclouen la determinació de la dosi terapèutica, els de fase 2 la determinació de l'eficàcia, i els de fase 3 la comparació del nou fàrmac amb el tractament estàndard. Finalment, es procedeix a la introducció de la nova droga en la pràctica mèdica general. Per aquestes raons, des de la primera síntesi de la nova substància activa fins a l'arribada al mercat d'un medicament nou, haurà transcorregut una mitjana de 14 anys.
El desgast, és a dir, el nombre de substàncies amb una interrupció precoç del desenvolupament, és molt alta en fases preclíniques: un 97,5% dels productes no superen aquestes etapes i la recerca s’atura. Concretament, de 200-250 productes registrats en estudis preclínics per ser provats en la investigació clínica, només n'hi haurà 5 en fase 2 i un únic fàrmac final comercialitzat.1 Mentre que el nombre de molècules desenvolupades en les fases 1 i 2 ha augmentat durant els últims deu anys, el nombre de productes que arribaven a fase 3 s’ha estancat.2 De mitjana, només una o dues de cada 10.000 substàncies sintetitzades en laboratori passaran amb èxit totes les etapes de desenvolupament necessari per esdevenir un medicament comercialitzable (figura 2). Si, a més, considerem que el cost mitjà de la investigació i el desenvolupament d'un nou producte és de l'ordre de 800 milions d’euros3 (figura 2), podem afirmar que de 10 drogues aprovades, només 2-3 són rendibles.4 Dit d’altra manera, només el 10% del negoci farmacèutic és rendible, mentre que un 30% arriba a l'equilibri financer, i un 60% presenta dèficit.5
El controvertit tema del preu dels tractaments per als pacients amb càncer
Les mesures de desenvolupament de la indústria d'un medicament contra el càncer són les mateixes que en els altres medicaments. No obstant això, en oncologia els temps d'estudi són més llargs que en el desenvolupament d’altres medicaments. En efecte, els processos de recerca són més complicats i més costosos degut a la subclassificació dels diferents subtipus de càncer segons les vies de senyalització patològiques, que compliquen significativament el seguiment dels assaigs. A conseqüència de la creixent epidemiologia i la revolució de la comprensió molecular dels càncers (gràcies als espectaculars avenços en l'anàlisi genètica d'alt rendiment), el camp de recerca de noves molècules ha augmentat considerablement en l'última dècada.6 El desenvolupament de fàrmacs oncològics té més en compte l'heterogeneïtat dels pacients i dels tumors per dirigir les teràpies segons les anomalies moleculars. Això fa que en un futur pròxim, el tractament del càncer pugui ser molt específic i determinat per l'anàlisi de la biòpsia del tumor. Malgrat aquestes consideracions, la inversió de la indústria en oncologia es manté, però l'explosió dels costos de medicaments que suposen, en particular les teràpies dirigides i la immunoteràpia, fa que les qüestions econòmiques es tornin crucials a l'hora de dissenyar un assaig clínic. Per exemple, per primera vegada aquest any en els estudis en què es comparaven dos tractaments i es trobava una eficàcia similar, es va considerar també la qüestió dels costos a l'hora de reflexionar sobre les estratègies terapèutiques a adoptar. Un altre exemple és el cas dels tractaments hormonals per al càncer de mama: la relació cost-benefici dels tractaments com ara l’exemestà, o altres inhibidors de l'aromatasa, o la dels més antics antiestrògens com el tamoxifè, s'avaluen tenint en compte la durada del tractament (per tant la despesa econòmica), els efectes secundaris i la qualitat de vida, entre altres factors.
Per avaluar aquests aspectes econòmics, la col·laboració entre recerca pública i recerca privada pot resultar important. La investigació i el desenvolupament farmacèutic a Europa és un sector econòmic important i dinàmic, essent, els països de la UE, entre els països del món més implicats en aquest sector. El 2013, aquesta indústria va invertir 30.630 milions d’euros en R+D a Europa. Dona treball directe a més de 690.000 persones i genera entre tres i quatre vegades aquest valor en llocs de treball indirectes. A diferència d'altres indústries, la investigació farmacèutica s'autofinança quasi íntegrament i percep unes subvencions anecdòtiques per part de l'estat. Com hem comentat abans, el sector s’enfronta a uns desafiaments reals, amb un increment de 10 vegades els costos d'R+D durant els darrers 30 anys degut a la creixent complexitat de les molècules produïdes, a l'augment dels requisits reglamentaris (nombre i durada dels estudis, nombre de pacients, metodologies) i l'allargament dels estudis clínics (protocols complexos més cars, raresa d'algunes patologies, plataformes tecnològiques, estudis de genòmica, imatges, proves de laboratori...).7 A causa de la situació econòmica i, en part, de les mesures d'austeritat fiscal introduïdes per gran part dels governs d'Europa des del 2010, el nombre de noves molècules procedents de la recerca i que han arribat a la comercialització ha disminuït considerablement des del 1990.8
No obstant això, l’oncologia representa uns dels sectors primaris en investigació i desenvolupament, tot i que sovint amb un impacte de gran increment en el preu dels tractaments oncològics. La situació és particularment espinosa amb els productes de teràpia dirigida i d'immunoteràpia. L’ipilimumab (Yervoy, laboratori Bristol-Myers Squibb costa 80.000 euros per a quatre injeccions, essent només eficaç en un pacient de cada cinc. Per tant, hem de determinar la durada òptima de la prescripció d'aquest anticòs monoclonal, per raons tan econòmiques com mèdiques (comporta una alta toxicitat).
Un altre exemple és el cas del Sovaldi, defensat per molts com el medicament miracle contra l’hepatitis C i comercialitzat per la companyia Gilead. A Europa (on es va aprovar al gener del 2004), aquest tractament de 12 setmanes ronda els 50.000 euros de mitjana. El seu desenvolupament va costar poc més de 62 milions de dòlars a Pharmasset, l'empresa que el va descobrir i que va ser adquirida per Gilead el 2011 per 11.000 milions de dòlars. Segons les dades enviades al regulador americà (SEC), en els primers nou mesos del 2014, Gilead ja havia ingressat una mitjana de 712 milions de dòlars al mes (total 6.408 milions) amb aquest fàrmac. D'acord amb els comptes reconeguts per l'empresa, Gilead ha doblat la seva facturació fins a setembre del 2014 respecte als nou primers mesos del 2013, amb un augment dels beneficis del 378%. Dit d’una altra manera, Gilead ha tingut ja uns magnífics resultats econòmics amb aquest fàrmac... A més, la polèmica està servida amb els informes publicats per diferents experts, que asseguren que el Sovaldi no costa més de 136 dòlars per a un tractament de 12 setmanes. Les autoritats sanitàries espanyoles van ser conscients des del primer moment d'aquestes xifres, raó per la qual es van negar a acceptar els preus que imposava el laboratori. Des que va ser aprovat per l'Agència Europea de medicaments, al gener del 2014, fins que finalment es va arribar a un acord van passar diversos mesos d'estira-i-arronsa. Finalment, el laboratori va acceptar una important rebaixa del preu que demanava inicialment i Sanitat va aprovar el seu finançament al novembre del 2014. Un altre argument utilitzat per negociar aquesta rebaixa, ha sigut la notícia que ben aviat vindran nous medicaments contra l'hepatitis C "més efectius". En efecte, es tracta dels nous fàrmacs de la companyia AbbVie, Viekira Pak i Technivie, ja aprovats per l'agència nord-americana, però que segons les últimes notícies podrien provocar lesions hepàtiques greus.
Poden fins i tot els països rics seguir pagant per tractaments amb costos de centenars de milers d'euros?
Segurament hi ha altres maneres de fixar els preus dels nous medicaments, altres models econòmics que garanteixin la sostenibilitat del nostre sistema social i la seva universalitat, de manera que els costos siguin suportables per l'assegurança de salut. Per exemple, per al Gleevec (teràpia dirigida desenvolupada per Novartis) es va fixar inicialment un preu molt alt (1.100 €), ja que estava previst per a la leucèmia mieloide crònica, un tumor poc freqüent amb una mitjana de 15 casos nous per any i per milió d'habitants. Però aquest fàrmac va demostrar ser eficaç també per al tractament d’altres tumors, i ara es prescriu a milers de pacients a tot Espanya. Evidentment sorgeix la pregunta: és legítim mantenir el mateix preu?
Aquestes consideracions econòmiques s’haurien de dur a terme de manera compartida entre la recerca pública, les associacions de pacients i els laboratoris farmacèutics, cadascú amb la responsabilitat de no bloquejar el sistema i permetre l'accés equitatiu als medicaments innovadors. El problema és que la majoria de les institucions públiques no tenen els mitjans per finançar aquest tipus d'investigació. En canvi, és important recordar que la indústria farmacèutica és una empresa privada amb finalitat de lucre, i per tant, la investigació, el desenvolupament i al final la comercialització de drogues en cadena ha de ser el més rendible possible.
REFERÈNCIES
1. Pharmaceutical Industry Profile, 2007, PhRMA.
2. Federació Europea d'Indústries i Associacions Farmacèutiques (EFPIA).
3. Mestre-Ferrándiz, Oficina d'Economia de la Salut, desembre del 2012.
4. Grabowski, H.G.; Vernon, J.; DiMasi, J.A. "Returns on Research and Development for 1990s New Drug Introductions”. PharmacoEconomis, 2002; 20:11-29.
5. DiMasi, J.A.; Hansen, R.W.; Grabowski, H.G.; Lasagna, L. "Cost of innovation in the pharmaceutical industry". J Health Econ, 1991; 10:107-42.
6. Bionest Partners.
7. DiMasi, J.A.; Grabowski, H.G. "The cost of biopharmaceutical R&D: is biotech different?", Managerial and Decision Economics, 2007; 28:468-79.
8. CMR International.