Element S
-
- Home
-
- 12 of 22
La S és la lletra essa majúscula de l'alfabet llatí. Però significa moltes més coses. Referint-nos només a la majúscula, és l'abreviatura del sud geogràfic, de les antigues matrícules de Santander, de les matrícules de Suècia... En ciència té també diversos significats. És la magnitud entropia, la representació de la superfície, la representació de l'aminoàcid serina, el símbol del siemens (unitat de conductància elèctrica), etc. I és el símbol del sofre. Naturalment, la lletra aïllada no permet saber a què es refereix, però el context permet deduir-ne fàcilment el significat.
Per al cas de la química, aquesta varietat de significats per a un sol símbol és encara més gran del que s'ha mostrat.
La definició d'element (element químic) de la IUPAC diu, una vegada traduïda:
1. Un dels tipus d'àtoms; tots els àtoms amb el mateix nombre de protons en el seu nucli atòmic.
2. Una substància química pura composta per àtoms amb el mateix nombre de protons en el seu nucli atòmic. A vegades aquest concepte es denomina substància elemental, entesa com a diferent de l'element químic definit a l'apartat 1, però en la majoria d'ocasions s'usa el terme element químic per a tots dos conceptes.
Hi ha, doncs, una superposició en la definició entre els àtoms com a tals i la substància que aquests àtoms formen, la substància elemental. Però certament la distinció entre element-àtom i element-substància elemental, que és implícita per a tot químic, no sol ser tan clara en els llibres de text ni en les divulgacions. Per complicar-ho tot, hi ha dos conceptes que fan que existeixi una pluralitat de formes en les quals es presenta un element químic: la isotopia i l'al·lotropia.
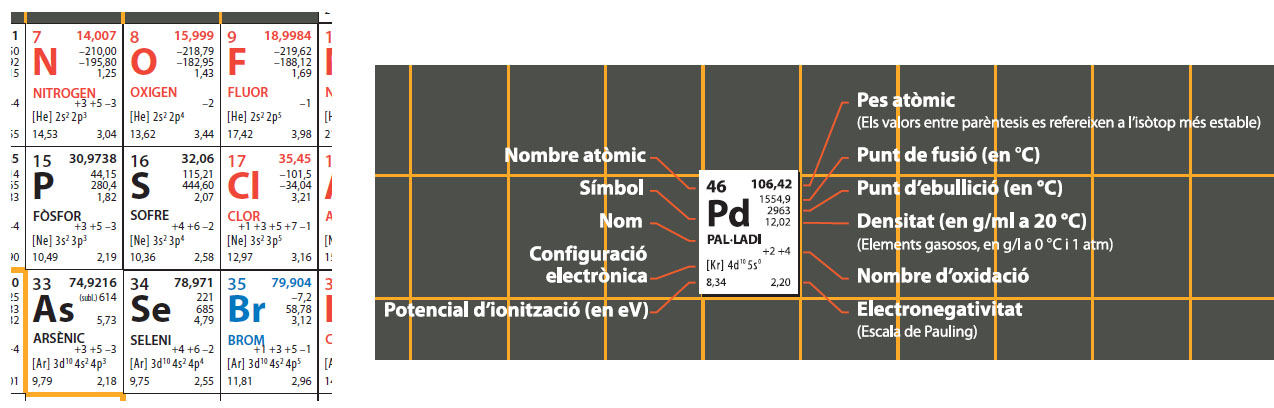
Figura 1. Taula periòdica molt difosa, la de la Societat Catalana de Química
Vegem una taula periòdica qualsevol, d'aquelles en què el dissenyador ha optat per col·locar força informació a cada element. A la Figura 1 es mostren nou caselles centrades en el sofre, d'una taula periòdica molt difosa, la de la Societat Catalana de Química. Al seu costat, la llegenda per desxifrar cadascun dels números i lletres de cada casella. La Figura 2 mostra un fragment de la pàgina de Wikipedia en espanyol corresponent a les propietats del sofre. En tots dos casos, algunes de les propietats que es mostren corresponen als àtoms de sofre com a tals: el seu nombre atòmic, els seus radis atòmics, la seva configuració electrònica (per al sofre, [Ne]3s23p4]). Però, al costat i sense distinció, apareixen un conjunt de propietats que només es poden atribuir a la substància elemental sofre: el seu punt de fusió, el seu punt d'ebullició, la seva calor específica, les seves conductivitats elèctrica i tèrmica, la seva densitat, la seva pressió de vapor. Un sol àtom de sofre no té cap d'aquestes propietats, que són macroscòpiques i atribuïbles només a una quantitat apreciable de la substància elemental sofre.
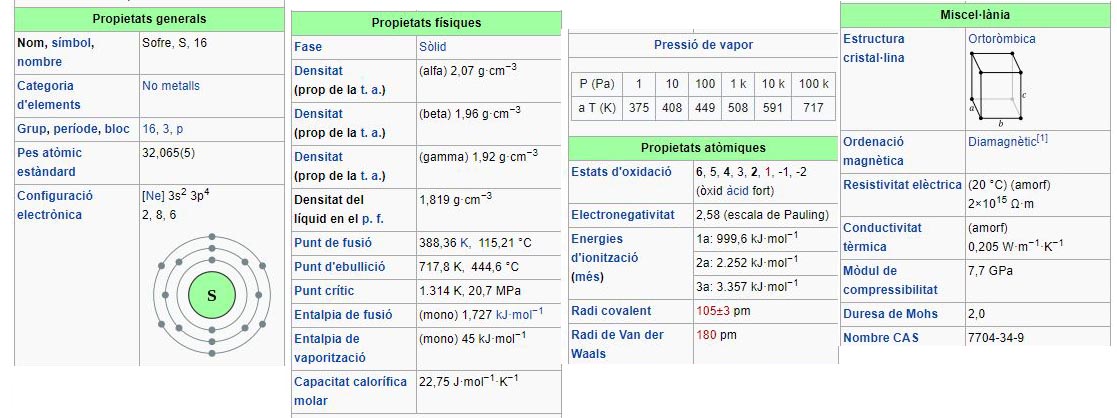
Figura 2. Propietats del sofre publicades a Wikipedia
El mateix pot dir-se del seu color, il·lustrat en la Figura 3: es mostra un fragment de la portada del llibre de Theodore Gray, The Elements (traducció al català), amb fotografies de Nick Mann. Aquí no hi ha dades, només fotos d'elements, és a dir, de substàncies elementals.
Portada del llibre The Elements, de Theodore Gray.
Compliquem-ho amb la isotopia. Tots els àtoms de sofre són representats per S, i tots tenen setze protons en el seu nucli. Però el seu nucli pot tenir un nombre diferent de neutrons, fins a vint-i-cinc valors diferents! Hi ha, doncs, vint-i-cinc tipus diferents d'àtoms de sofre, entre el 29S i el 49S, que tenen respectivament entre 13 i 33 neutrons. Cadascun és un isòtop del sofre (d'isos, 'el mateix' i topos, 'lloc': ocupen el mateix lloc a la taula periòdica), amb les mateixes propietats químiques, però amb alguna diferència pel que fa a les propietats físiques. Hi ha només quatre isòtops estables, 32S, 33S, 34S i 36S, amb unes abundàncies de 95,02%, 0,75%, 4,24% i 0,02%. La resta són isòtops radioactius, amb períodes de desintegració de pocs mil·lisegons o nanosegons. Tots aquests són l'àtom de sofre. Aquesta diferent abundància dels isòtops és la que explica que les masses atòmiques dels elements siguin normalment valors decimals.
La major part d'elements tenen isòtops, començant per l'hidrogen que en té tres: l'hidrogen ordinari 1H, el deuteri 2H (a vegades representat per D), i el triti 3H (a vegades representat per T). Entre tots els elements hi ha 256 isòtops estables, i moltíssims més d'inestables [+].
I la substància elemental sofre? Com altres elements, presenta el fenomen de l'al·lotropia. Els al·lòtrops són "les diferents modificacions estructurals d'un element", segons la IUPAC. El terme prové del grec állos, 'diferent', i tropos, 'forma', que traduït significa que la substància pot trobar-se en diferents agrupacions moleculars d'àtoms units de diferents formes, en número i en estructura. Són ben conegudes les formes al·lotròpiques del carboni: el diamant, estructura cristal·lina en forma de xarxa tetraèdrica, el grafit, en forma de làmines amb xarxes bidimensionals hexagonals; el grafè, que són làmines individualitzades de grafit; els ful·lerens, estructures esfèriques de composició C60 o similars, i els nanotubs de carboni, que són com làmines de grafit enrotllades com tubs. Un concepte més general, que s'aplica no només a elements sinó a compostos, és el de polimorfisme, que és la possibilitat que una mateixa substància es presenti en forma de diferents estructures cristal·lines.
Doncs bé, el sofre, la substància elemental sofre, és la que més al·lòtrops mostra de tots els elements de la taula periòdica. Pot presentar-se en no menys de vint formes. Les més simples són molècules diatòmiques S2, triatòmiques S3 o tetraatòmiques S4, presents en el sofre vapor. S'han identificat diverses molècules en forma d'anell de cinc, sis o vuit àtoms de sofre units (S5, S6 i S8) i encara altres cicles de fins a 20 nuclis de sofre. Existeixen també cadenes, no tancades, i mescles de diversos al·lòtrops. Molts d'aquests al·lòtrops, a més, es poden presentar en diferents formes cristal·lines. Existeixen també formes de sofre amorf.
El sofre, el sòlid groc que tots coneixem, està format molt majoritàriament per anells de vuit àtoms en forma de corona, el S8 o ciclooctosofre, amb petites proporcions del cicle S7. És la forma més estable a temperatura ordinària, i rep diferents noms comuns: sofre ortoròmbic, flor de sofre, sofre ròmbic i altres. És la típica substància groga de la Figura 3. Aquesta substància elemental, la més estable dels al·lòtrops del sofre en condicions normals, és la que té les propietats físiques i químiques que apareixen en les caselles de les taules periòdiques: té densitat, punt de fusió, conductivitat tèrmica i elèctrica, pressió de vapor, duresa, color... Cadascun dels vuit àtoms de sofre que formen el cicle comparteixen un electró amb els seus dos àtoms veïns, donant enllaços covalents bastant forts. Aquests anells s'uneixen després amb uns altres mitjançant enllaços febles, formant estructures denominades sòlids moleculars.
En resum, tenim dotzenes d'àtoms i de substàncies elementals, totes amagades sota el simple símbol S. La diferència entre els conceptes d'àtom i de substància elemental fa que algunes poques taules periòdiques, com l'editada per l'IQS, els distingeixin. Així, en una cara de la taula descriuen les propietats dels àtoms, i en l'altra cara indiquen les propietats de la substància elemental, i en particular la seva fórmula. En les caselles dels gasos nobles, substàncies monoatòmiques, apareixen els símbols clàssics: He, Ne, Ar. Els elements gasosos no nobles solen ser diatòmics: F2, Cl2, N2, O2. El sofre apareix amb el seu S8 ja vist, el fòsfor és P4. I tots els metalls tenen fórmules tipus Nan, Fen, Pbn, indicant amb n l'estat metàl·lic format per infinitat de nuclis de l'element units pel núvol electrònic comú.
I encara hi ha un tercer concepte addicional: el del sofre combinat, és a dir, l'àtom de sofre que podem imaginar que comparteix els seus electrons amb altres elements, en formes variades. Així, el sulfur de ferro, FeS, que es forma entre la clara i el rovell d'un ou dur i que li dona una tonalitat verdosa. Aquí l'àtom de sofre ha guanyat dos electrons del ferro i s'ha convertit en l'ió sulfur, S2-, que s'uneix mitjançant atracció electroestàtica –un enllaç iònic– a l'ió ferro Fe2+.
O, en el cas de l'àcid sulfúric i dels sulfats (H2SO4 i SO42-, respectivament), on el S central comparteix sis electrons amb quatre oxígens del seu voltant mitjançant enllaços covalents de diferents tipus. Podem continuar denominant àtoms de sofre aquests nuclis de sofre que han cedit dos electrons, o que han compartit tots els electrons del seu nivell exterior? Per descomptat que no. El primer és una entitat química diferent denominada ió sulfur, i el segon forma part d'una entitat química denominada ió sulfat. El sofre pot formar milers de combinacions diferents, i en cap trobem l'element sofre com a tal. I el mateix passa amb tots els elements.
En resum, és correcte parlar dels àtoms de l'element sofre quan estan aïllats, i quan ens referim a la idealització de l'àtom, a l'estructura electrònica formada per un nucli de 16 protons i un nombre de neutrons entre 13 i 33 (el conjunt d'isòtops), amb 16 electrons en el seu entorn. També és correcte parlar de la substància elemental sofre, que pot existir en forma de més de vint al·lòtrops, dels quals el més comú és el S8. I és també correcte parlar dels compostos amb sofre, en què la preposició amb indica que aquí el sofre ha sofert canvis en la seva estructura electrònica i ja no té ni l'estructura electrònica de l'àtom de sofre ni les propietats físiques i químiques de la substància elemental sofre, sinó que estem en presència d'altres substàncies químiques diferents, les propietats de les quals no tenen per què tenir res a veure amb les propietats dels elements que constitueixen les seves molècules.
Totes aquestes distincions no són divertiments de químics, sinó distincions pertinents per a una comunicació veraç. Alguna vegada he vist descriure el clorur de sodi, la nostra sal de taula, com a compost que conté dos elements molt perillosos: el clor, gas tòxic, i el sodi, que crema en contacte amb l'aigua. Tingueu cura amb la sal!