Fou la primera que intentà d’explicar les desviacions dels comportaments dels gasos respecte a la idealitat. Té la forma
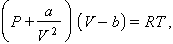
a i b essent dues constants introduïdes per a tenir en compte, respectivament, la cohesió entre les molècules (forces de van der Waals) i llur volum. Des d’un punt de vista termodinàmic, aquestes constants depenen de la pressió i el volum crítics de cada gas en particular. Tot i representar una gran millora envers l’equació del gas perfecte (gas 1 2), existeixen també desviacions respecte a aquesta, pel fet que les constants a i b depenen igualment de la temperatura (equació del virial).