El carboni terrestre es compon dels núclids 12 (98,9%) i 13 (1,1%), i el gas carbònic atmòsferic (CO2); conté, a més, un percentatge petit, però constant, de carboni 14, isòtop radioactiu; hom coneix els núclids artificials 10, 11 i 15; el 14 també ha estat obtingut artificialment. La massa atòmica és 12,01115; la massa atòmica del núclid 12 ha estat escollida com a base del sistema internacional de masses atòmiques.
Constitueix el 0,2% de l’escorça terrestre; és rar en les roques eruptives, però abunda en les sedimentàries, en els jaciments de combustibles sòlids i líquids (hulla i hidrocarburs) i en els enormes dipòsits de carbonats, que caracteritzen certes capes geològiques. També existeix, sota forma de diòxid de carboni, en l’atmosfera i en les aigües naturals. Els composts de carboni i d’hidrogen i els cossos orgànics que en deriven constitueixen la matèria fonamental de tots els organismes vivents; el carboni és l’element més abundós en el cos humà (17,5%) després de l’hidrogen i de l’oxigen. El carboni existeix a l’estat natiu, en petites quantitats, sota dues formes al·lotròpiques, el grafit i el diamant, d’estructures i de propietats físiques força diferents; el grafit és la forma estable a tota temperatura sota la pressió ordinària, i la reacció
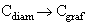
allibera 2,1 kJ per mol.
Les varietats de carboni dites amorfes contenen partícules microcristal·lines d’estructura grafítica, i es presenten sota formes i noms diversos: fum d’estampa, negre de carboni, negre d’acetilè, negre animal, coc, carbó de retorta, carbó de sucre, carbó vegetal, etc. La part més important del carboni emprat industrialment prové de la fossilització dels vegetals; la proporció de carboni dins aquests productes naturals, els carbons, és tant més important com més llunyana és l’època de llur formació; aquestes substàncies, d’estructura complexa, posseeixen funcions àcides (àcids húmics) i l’estat en el qual es troba el carboni no és encara netament determinat (hulla, antracita, lignit i torba).
La indústria prepara grafits artificials a partir de coc d’hulla o de petroli, els quals són materials durs i resistents, que serveixen per a fabricar elèctrodes, gresols, resistències elèctriques, etc, i plaques per a aturar i reflectir el flux de neutrons de les piles atòmiques; també prepara un grafit dit pirolític o pirografit, cos d’una anisotropia remarcable, de gran conductibilitat tèrmica i elèctrica i molt resistent a l’oxidació. La situació del carboni en l’eix de la taula periòdica a mig camí entre els elements més electropositius i els més electronegatius, en “el punt d’inversió de les afinitats”, explica la varietat dels cossos que permet d’obtenir i la multiplicitat de les reaccions en les quals participa. De petites dimensions, l’àtom de carboni posseeix quatre electrons de valència en la capa L i no pot donar sals binàries iòniques, puix que tant la formació del catió C4+ com la de l’anió C4- són energèticament molt desfavorables. En conseqüència, el carboni s’uneix als altres elements formant enllaços covalents o coordinats.
L’àtom de caboni és representat en l’espai des del temps de Jacobus van’t Hoff i Josep Achille Le Bel (1874) sota la forma d’un tetràedre regular cap a cada vèrtex del qual es dirigeix una valència; hom explica actualment més correctament la configuració espacial de les molècules dels composts de carboni mitjançant la teoria de la hibridació dels orbitals. Les propietats químiques del carboni són comunes a les seves diferents formes al·lotròpiques, però aquestes reaccionen amb velocitats diferents. El carboni s’uneix a l’hidrogen a temperatura molt elevada donant acetilè (reacció descoberta el 1862 per Berthelot, la qual esfondrà definitivament la teoria de la “força vital” com a base de la química dels composts orgànics); a temperatures més baixes dóna reversiblement metà, segons una reacció relacionada amb les del procediment modern d’hidrogenació de l’hulla. S’uneix a nombrosos metalls a la temperatura del forn elèctric donant carburs. El carboni, actuant com a element electropositiu, es combina amb el fluor i dóna tetrafluorur de carboni, CF4, però no amb els altres halògens (llevat del clor a alta temperatura i amb rendiment ínfim). El carboni s’inflama en atmosfera d’oxigen o d’aire quan hom el porta a una certa temperatura inicial que depèn de la varietat al·lotròpica: 800-850°C per al diamant, 700°C per al grafit, i 350°C per al carboni amorf. La combustió del carboni en excés d’aire no produeix temperatures superiors a 500°C i condueix a la formació de diòxid de carboni, únicament: C + O2 →CO2 la reacció és fortament exotèrmica: dóna 393 kJ/mol. A una temperatura superior a 1.000°C la combustió produeix òxid de carboni:2C + O2→;2CO, ΔH = - 220kJ; si la combustió té lloc entre 500 i 1.000°C els gasos obtinguts són una barreja dels dos òxids; com més elevada és la temperatura, més important és la proporció del monòxid.
El carboni posseeix propietats reductores importants; el vapor d’aigua és reduït pel coc incandescent (1.000°C) segons la reacció: 2C + HO2 →CO +H2, ΔH = 130 kj; la barreja de gasos obtinguda és emprada com a combustible o per a la preparació de diferents productes de síntesi (amoníac, alcohol metílic i d’altres). Si la temperatura no és mantinguda a 1.000°C es produeix una altra reacció: C + 2H2O →CO2 + H2, ΔH = 84 kJ; i hom obté un gas combustible menys ric en calories. En absència d’oxigen, el carboni redueix gairebé tots els òxids metàl·lics a metall; la reacció és total a 600°C per als metalls més nobles (or, argent, plom, coure, etc); per als òxids de zinc, de ferro i de manganès, més estables, la reacció total es produeix entre 1.000 i 1.500°C segons els casos; per als metalls molt oxidables (alumini, calci, magnesi, etc) és necessària la temperatura del forn elèctric, però aleshores l’obtenció del metall pur és gairebé impossible i és obtingut, en principi, el carbur corresponent. El carboni redueix fàcilment els àcids i les sals oxigenades: l’àcid sulfúric i el nítric són reduïts abans de l’ebullició; l’àcid nítric fumant ho és a la temperatura ordinària amb incandescència; l’àcid fosforós i l’anhídrid fosfòric són reduïts a 1.000°C i la reacció és emprada per a l’obtenció del fòsfor; els sulfats són reduïts a la temperatura del roig viu. La reducció dels nitrats, dels clorats i sobretot dels perclorats dóna lloc a reaccions explosives, propietat utilitzada per a la fabricació de la pólvora ordinària (barreja de nitrat de potassi, de carbó i de sofre). Els fosfats, carbonats i arsenats són reduïts a temperatures superiors a 1.000°C i donen diferents productes: fosfurs, arsenurs, arsènic, òxid de carboni. Abans de la descoberta dels procediments electrolítics, el sodi era preparat per reducció del carbonat de sodi (Na2CO3) pel carboni a 1.200°C. A la temperatura de l’arc elèctric el carboni s’uneix al nitrogen i hom obté cianogen: 2C + N2 →C2N2, Δ= +305 kj; en presència d’hidrogen es produeix cianur d’hidrogen: C2N2 + H2 →2HCN, ΔH = -46kJ. El silici i el bor donen directament carburs (SiC i B4C) a una temperatura de l’ordre dels 2.000°C.
El carboni, malgrat no reaccionar fàcilment amb l’hidrogen, dóna amb aquest element un nombre increïblement elevat de composts, l’estudi dels quals constitueix l’objecte de la química orgànica. El caràcter únic del carboni en aquest sentit prové de la solidesa de l’enllaç entre els seus propis àtoms (enllaç C-C), fort fins i tot quan els àtoms de carboni són lligats amb altres elements, a diferència del que s’esdevé amb el bor, el silici, el fòsfor, etc, a partir dels quals no poden ésser preparats composts estables anàlegs als de carboni.
La química del carboni ha sofert una gran ampliació els darrers anys amb el descobriment dels ful·lerens, els nanotubs i la nanoescuma a més de l’obtenció d’una varietat de grafit magnètica per irradiació amb protons. Pel que fa a altres formes del carboni, s’ha comprovat que l’estructura interna del carboni activat és una xarxa de canals i porus que segueix un patró fractal. A més, s’ha obert la possibilitat d’estudiar la química del carboni líquid gràcies a experiments que empren làsers per a escalfar la mostra de carboni a temperatures de milers de kelvins.
Propietats físiques del carboni
| nombre atòmic | 6 |
| pes atòmic | 12,011 |
| estructura electrònica | [He] 2s22p2 |
| valències | 2, ± 4 |
| pes específic (a 20ºC) | 2,26 |
| punt de fusió | 3.550ºC |
| punt d’ebullició | 4.827ºC |
| conductivitat tèrmica (del sòlid amorf, a 25ºC) | 0,0159 W/cm·K |
| resistivitat elèctrica (del grafit, a 0ºC) | 1.375 μ Ω·cm |
| radi iònic (Ca+4) | 0,16 Å |
| radi metàl·lic | 1,4447 Å |
| potencials d’ionització, en eV | I: 11,260; II: 24,383; III: 47,887 |
El carboni com a element essencial dels compostos orgànics
La propietat que té el carboni d’establir enllaços covalents (simples, dobles o triples) amb altres àtoms del mateix element li permet constituir cadenes (obertes, com les de molts hidrocarburs, base dels àcids grassos, o bé tancades, com el cicle benzènic). També el nitrogen pot formar part d’aquestes molècules lineals o cícliques, formant cadenes —C—C—N—C—C—N—, que constitueixen l’esquelet de les proteïnes, o heterocicles, com els que formen part dels àcids nucleics, auxines, etc. Ultra això, moltes molècules orgàniques poden polimeritzar-se, formant-ne d’altres de més complexes. Únicament els composts carbonats poden atènyer la complexitat i la diversitat necessàries per a poder realitzar les reaccions implicades en la vida (intercanvis d’energia, emmagatzematge d’informació, funció plàstica, etc). Bé que el carboni és un element rar en el conjunt del cosmos (0,15%), els éssers vius han sabut concentrar-lo i incorporar-lo a llur organisme (10-19% per terme mijtà). En refredar-se la Terra, la major part del carboni degué restar en forma de diòxid de carboni (CO2) formant, juntament amb nitrogen, metà, amoníac, etc, l’atmosfera primitiva. Bona part d’aquest CO2 es dissolgué aviat en la hidrosfera, on passà també a les formes d’ió bicarbonat i d’ió carbonat. Aquesta reserva, principalment oceànica, actuà des d’aleshores com a factor estabilitzador de primera importància del CO2 atmosfèric. Principalment per l’activitat dels organismes fotosintetitzadors (que supera àmpliament la dels heterotròfics) una part del carboni anà quedant fixada en forma de matèria orgànica i carbonats. L’oxigen sobrer anà enriquint la composició de l’aire, que al principi n’estava privat. Com a resultat d’aquesta activitat, la proporció de CO2 a l’atmosfera anà disminuint, talment, que ara la major part del carboni (50 vegades el que hi ha en els éssers vius) es troba immobilitzat en forma de sediments organògens (sobretot carbonats, com calcàries i dolomies, i matèria orgànica fòssil, com carbons i petroli). La proporció actual de CO2 a l’atmosfera és d’unes 320 parts per milió, amb tendència a tornar a augmentar, per efecte de la combustió de carbons i petroli, calcinació dels carbonats, etc. En el mar, a més del carboni que forma part dels éssers vius, hi ha el de la matèria orgànica morta en forma de partícules en suspensió (unes deu vegades més que el primer) i de la matèria orgànica dissolta (unes trenta vegades el primer). Sobre la litosfera, les màximes acumulacions de carboni es troben a les plantes lignificades dels boscs i en la matèria orgànica del sòl.