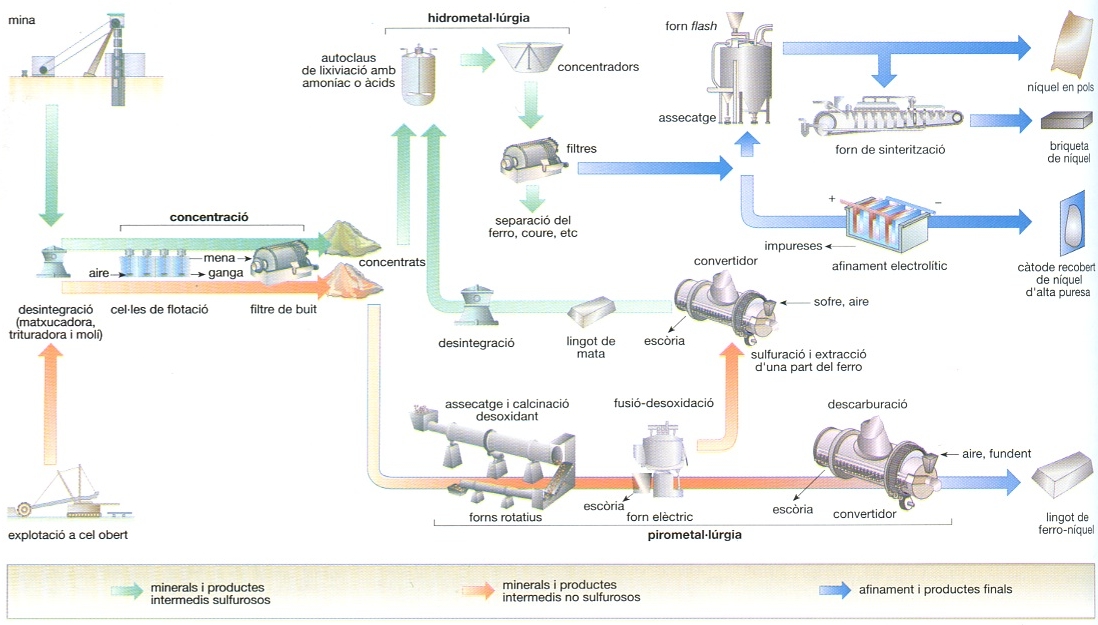
El producte natural és format per cinc isòtops estables (58, 60, 61, 62 i 64). Hom n’ha pogut obtenir set isòtops radioactius. Té una tonalitat d’un color blanc grisenc, i és mal·leable, però és fràgil quan conté petites quantitats de sofre. El metall fou aïllat el 1751 per A.F. Cronstedt, a partir de la niquelina (NiAs). La seva abundància a l’escorça terrestre és d’un 0,018%. Es troba en l’estat natiu en els meteorits, on forma aliatges amb el ferro; a les roques lunars portades per l’Apol·lo-11, hom el troba en uns percentatges del 0,004%. Els minerals més importants són la polidimita i la pentlandita. El níquel és present en totes les terres de conreu (de 2 a 17 ppm); amb tot, no és indispensable, com el cobalt, per a la vida de les plantes, per a les quals un excés de níquel és fins i tot tòxic. Hom obté en el laboratori petites quantitats de níquel emprades com a catalitzador; el níquel reduït, emprat per P. Sabatier i J.B. Senderens en les hidrogenacions orgàniques, és preparat reduint l’òxid o l’hidròxid de níquel per l’hidrogen entre 300°C i 500°C. Sigui quin vulgui el mètode de preparació, el níquel és sensible a l’acció de metzines catalítiques i sofre, seleni, tel·luri, arsènic, mercuri i plom; inversament, els òxids, com ThO2 , Al2O3 i Cr2O3 , en milloren l’activitat catalítica i permeten d’augmentar la velocitat de les reaccions. Actua amb les valències +2 i +3, i rarament amb les valències +1 i +4. A més de les sals normals, forma nombrosos complexos, que presenten un índex de coordinació de 6 o de 4. El metall no s’oxida pràcticament en fred i en contacte amb l’oxigen, però per escalfament al voltant dels 600°C un fil de níquel crema i es recobreix d’una pel·lícula d’òxid de colors diversos. Cal fer notar que una solució aquosa de CO2 ataca lentament el metall, i hom creu que es forma hidrogenocarbonat de níquel. Ni la potassa ni la sosa ataquen el metall a la temperatura ordinària, però aquest atac esdevé molt ràpid cap als 600°C; si aquestes bases contenen un peròxid o un nitrat alcalí, es forma Ni2O3. L’àcid clorhídric, l’àcid sulfúric, l’àcid nítric, l’àcid fosfòric, l’aiguafort, l’àcid cròmic i les solucions d’alum fèrric l’ataquen més o menys de pressa; l’amoníac dissol el níquel polvoritzat, amb formació d’un catió violeta [Ni(NH3)6]2+. El mètode escollit per a l’extracció del níquel és determinat per la composició del material que cal tractar; comprèn trituració, flotació —per a eliminar la roca i obtenir un concentrat de sulfur que contingui el níquel, el coure i el ferro— i flotació diferencial, per a obtenir un concentrat de ferro i un altre de níquel; aquest darrer és sotmès a un procés de torrefacció i de fusió amb un fundent, per a eliminar les roques i una part del ferro en forma d’escòria; així hom obté una mata de níquel i de ferro que conté coure, la qual és sotmesa a l’acció del forn Bessemer per tal d’eliminar-ne el ferro i el sofre. La separació final de níquel, coure i metalls preciosos és obtinguda tractant la mata fosa del Bessemer amb un refredament controlat, trituració, separació magnètica i flotació diferencial. Els aliatges de níquel-coure, níquel-crom i níquel-ferro tenen un ampli ventall d’aplicacions. El níquel és emprat per a fabricar estris de cuina, objectes de laboratori, instruments de cirurgia i elèctrodes. Entre els composts, hom empra el sulfat per als banys de galvanoplàstia i l’òxid per a la fabricació d’esmalts i de vidres acolorits.
La producció mundial de níquel
El 1974 la producció mundial de níquel fou de 736.500 tones, i el 1983 baixà a 653.700 t. L’any 1974 el Canadà fou el primer productor amb 269.100 t, però als anys vuitanta ocupava el segon lloc amb 121.800 t (1983); s’hi destaca el districte de Sudbury (Totten, Copper Cliff North, Kirkwood, Coleman, Little Stobie, Frood Stobie), a Ontario, i els de Lynn Lake, Thompson, Creighton, Birchtree i Soab, a Manitoba. El mineral canadenc és fos i refinat a Port Colborne, Fort Saskatchewan i Sheritt Gordon. L’URSS, que fins els anys vuitanta era el segon productor mundial (120.000 t el 1974), passà a ocupar el primer lloc amb 172 000 t el 1983; hi destaquen com a centres de producció Verhni Ufalej, Mončegorsk, Orsk, Murmansk i Talnak. Els restants productors segueixen a una gran distància: Nova Caledònia (46.200 t el 1983), Cuba (39.200 t), Sud-àfrica (20.500 t), Grècia (12.900 t), i alguns altres productors menors. La comercialització és sotmesa a règim de quasi monopoli: un càrtel format per poques grans empreses occidentals n’absorbeix el 90%, mentre que el 10% restant correspon a l’URSS i a Cuba.
Propietats físiques del níquel
| nombre atòmic | 28 |
| pes atòmic | 58,71 |
| estructura electrònica | [Ar] 3d8 4s2 |
| estats d’oxidació | +2, +3 |
| densitat | 8,9 g/ml |
| punt de fusió | 1 453ºC |
| punt d’ebullició | 2 732ºC |
| radi iònic (Ni+2) | 0,69 Å |
| potencial d’ionització, en eV | I: 7,635 |
| II: 18,168 | |
| III: 35,17 | |
| conductivitat tèrmica (a 25ºC) | 0,909 W/cm∙K |
| resistivitat elèctrica (a 20ºC) | 6,84 μΩ∙cm |
| duresa Brinell | 90-100 kg/mm2 |