La nitració de composts aromàtics té lloc mitjançant l’acció de l’àcid nítric en el si d’un solvent determinat. Les nitracions aromàtiques són reaccions de substitució electròfila i resten sotmeses als efectes orientadors i activadors (o desactivadors) dels substituents. Així, el grup -NO 2 és un substituent desactivant, que orienta en posició meta ,
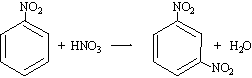
mentre que l’hidroxil d’un fenol és un substituent activant i orienta en les posicions orto i para ,
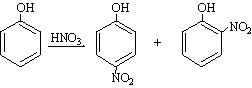
El mecanisme normal de nitració implica la producció, a partir de l’àcid nítric, de l’ió NO 2 + i l’ulterior atac per part d’aquest ió del compost que cal nitrar. L’àcid sulfúric, que és el solvent més usual en les nitracions, permet la conversió gairebé total de l’àcid nítric en ió NO 2 + . Els composts fortament activats, com els fenols o les amines aromàtiques, poden ésser nitrats en medi aquós, en el qual l’ió NO 2 + no pot existir en quantitat apreciable. Aquestes nitracions són catalitzades per l’àcid nitrós; el mecanisme comprèn una nitrosació (formació d’un derivat nitrosat) i una ulterior oxidació del producte nitrosat en producte nitrat. Les reaccions de nitració tenen una extraordinària importància pràctica; nombrosos explosius, per exemple, són composts nitrats. D’altres derivats són intermediaris útils; poden, doncs, ésser reduïts a amines, que tenen un gran interès en la preparació de colorants, de medicaments i d’altres productes.