És conegut per l’home des de l’antiguitat, atesa la seva ocurrència en forma nativa. El sofre natural és constituït per una mescla de quatre isòtops naturals, estables, amb masses 32 (95,0%), 33 (0,76%), 34 (4,22%) i 36 (0,14%), que determinen un pes atòmic de 32,06. Són coneguts, a més, sis radioisòtops artificials de l’element, un dels quals, 35S, amb una vida mitjana de 87 dies, és emprat com a traçador. El sofre és el setzè element més abundant de l’escorça terrestre, de la qual constitueix un 6 × 10-2 per cent en pes. La seva presència ha estat detectada al Sol i als estels novae, a la Lluna i als meteorits. Les formes més importants d’ocurrència del sofre són els sulfurs (calcopirita, cinabri, esfalerita, estibnita, galena, pirita, etc.), els sulfats (anhidrita, baritina, celestina, epsomita, etc.) i el sofre elemental (fumaroles, solfatares i dipòsits sedimentaris provinents de la reducció del guix). Hom el troba també com a component minoritari al gas natural i al petroli. L’obtenció de l’element és duta a terme tant per recuperació dels subproductes (SO2 i H2S) de la metal·lúrgia dels sulfurs o de la indústria del gas natural, com a partir dels dipòsits sedimentaris elementals, per simple extracció, que hom realitza mitjançant el procés Frasch, consistent en la injecció de vapor d’aigua a l’interior de la mina per tal de fondre el sofre, el qual és impel·lit cap a la superfície mitjançant aire a pressió. El sofre es presenta en forma d’un sòlid groc clar, inodor i insípid, fràgil, mal conductor de la calor i de l’electricitat, insoluble en l’aigua i soluble en el sulfur de carboni. És constituït per molècules cícliques de S8 , i pot existir en dues varietats cristal·lines: α (ròmbica) i β (monoclínica), amb temperatura de transició de 95,6°C. El sofre monoclínic es fon a 119,3°C i dona lloc a un líquid diamagnètic, poc viscós, que escalfat a 185°C esdevé paramagnètic i augmenta vint mil vegades la seva viscositat, a causa de la transformació dels cicles de S8 en cadenes lineals Sn. A temperatures superiors la viscositat decreix; el sofre bull a 444,7°C i dona lloc a un vapor constituït per molècules de S8, que a temperatures superiors se simplifica progressivament en S6, S4, S2 i S. A més, per refredament brusc del sofre escalfat a diverses temperatures hom obté tota una gamma de varietats inestables de l’element. Des del punt de vista químic, el sofre difereix notablement de l’oxigen, el primer element del grup VIA, pel fet que presenta una molt més petita electronegativitat, que ocasiona un caràcter molt més covalent en els enllaços i produeix variacions en la reactivitat dels composts organics en els quals l’oxigen ha estat substituït per sofre inversió de reactivitat; té una forta tendència a la catenació, que es manifesta en l’estructura del sofre elemental i en la formació de diversos composts (polisulfur, sulfà, àcid tiònic), i presenta una coordinació màxima de sis, gràcies a la intervenció en l’enllaç dels orbitals d buits del sofre. El sofre presenta una reactivitat elevada, s’uneix directament amb la majoria dels altres elements i gaudeix de propietats reductores. S’encén en l’aire per formar el diòxid (SO2) i es combina, en calent, amb halògens, amb uns altres no-metalls i amb la gran majoria de metalls. No és afectat pels àcids no oxidants, però es dissol en l’òleum. Reacciona amb una varietat de composts orgànics: deshidrogena els alcans i s’addiciona a les olefines vulcanització, amines i altres nucleòfils. Forma tres sèries de composts, en els quals actua amb les valències 2 (sulfurs, polisulfurs, sulfans i halogenurs), 4 (diòxid de sofre, halogenurs, sulfits i halogenurs de sulfinil) i 6 (triòxid de sofre, àcid sulfúric, halogenurs, sulfats i halogenurs de sulfonil). Intervé en la constitució de tota una gamma de grups funcionals de la química orgànica i dona lloc a diversos tipus de composts: tiols (R-SH), tioèters (R-S-R), tioaldehids i tiocetones
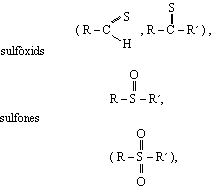
tiocianats (R-SCN), isotiocianats (R-NCS), àcids sulfònics (R-SO3H), àcids sulfínics (R-SO2H), àcids sulfènics (R-SOH), àcids tiocarboxílics (R-COSH i R-CS2H), etc. A més, el sofre té un important paper biològic. Intervé en la constitució de diversos aminoàcids, com la metionina, essencial per al creixement, i en el parell cistina-cisteïna, un dels constituents fonamentals de la ceratina. Ocorre també en la constitució d’enzims i hormones (acetilcoenzim A, coenzim A), així com en les vitamines B2 (tiamina) i H (biotina). El sofre és imprescindible per als organismes vius, bé que amb necessitats diàries encara no prou ben determinades. La seva dosi ha d’ésser subministrada totalment en la dieta i prové, en darrer terme, del sòl, d’on és absorbit en forma de sulfat per les plantes. El sofre troba nombroses aplicacions i és una de les matèries bàsiques per a la indústria química. La major part del sofre consumit és emprat en la fabricació de l’àcid sulfúric i els sulfats. Unes altres aplicacions de l’element són la preparació de la pasta de paper, com a fungicida agrícola i fertilitzant, en la vulcanització del cautxú, fabricació de la pólvora negra i preparació del disulfur de carboni (CS2), sulfonats i altres composts.
És utilitzat en agricultura com a producte fitosanitari i té diverses aplicacions: raticida, fungicida contra oïdis i acaricida. És autoritzat en un gran nombre de conreus, però pot produir problemes de fitotoxicitat si hom l’aplica a temperatures elevades (superiors a 28ºC). També és emprat per a realitzar esmenes minerals al sòl, per a corregir deficiències d’aquest element i per a potenciar les seves funcions en els sòls bàsics, ja que facilita la solubilització del fòsfor i l’alliberació de calci i altres elements. Hom l’utilitza sobretot en cultius de crucíferes, lleguminoses, bleda-rave i pastanaga. Hom troba aquesta matèria activa al mercat de productes fitosanitaris sota diferents noms, segons la riquesa, la formulació i l’empresa que la comercialitza.
Explotació del sofre
El sofre és un dels minerals no metàl·lics la demanda del qual ha augmentat més durant el segle XX, en funció en gran part de l’increment experimental per les seves aplicacions industrials. Encara que manquen estadístiques completes i la producció global és desconeguda, hom pot assegurar que els EUA són el principal productor mundial i obtingueren el 1973 215.000 t de sofre de pirites, 7.727.000 en estat lliure i 2.445.000 com a subproducte del tractament d’altres minerals. El Canadà, segon productor, n’obtingué 4.796.000 t del gas natural i 56.000 de les pirites. També l’Estat francès n’obté quantitats considerables del tractament del gas natural (1.753.000 t el 1973), arran sobretot de l’explotació dels jaciments de Lacq. A Itàlia es troben grans jaciments de sofre natural a Sicília (778.000 t el 1973) i més petits a Calàbria; però uns i altres estan a punt d’exhaurir-se o d’ésser abandonats (els de Sicília, procedents d’erupcions de l’Etna, ja eren explotats a l’època clàssica). A l’Estat espanyol, hom obtenia sofre natural. Amb tot, la importància relativa de la producció espanyola ha decrescut, després d’haver estat la tercera del món abans de la Segona Guerra Mundial; ha baixat al vuitè lloc des dels anys setanta. L’exportació de sofre espanyol, o més aviat de pirites, apreciades pel seu alt contingut de sofre (després d’haver fracassat com a mena de metalls), troba mercats a Alemanya, la Gran Bretanya, Bèlgica i Holanda. En conjunt, doncs, la producció més important surt del continent nord-americà (els EUA, el Canadà, Mèxic). També és notable a Europa (Polònia, França, Espanya), l’URSS, Àsia (la Xina i el Japó) i, en menor escala, a l’Àfrica. El sofre natiu es limita (en quantitats industrials) a regions volcàniques. Del gas natural hom n’obté molt com a subproducte, però la font més generalitzada són les pirites que, malgrat una forta minva, són extretes sobretot a l’Àsia (la Xina, el Japó), Europa (Espanya, Finlàndia, Itàlia, etc.) i Àfrica (Sud-àfrica).
Propietats físiques del sofre
| nombre atòmic | 16 |
| pes atòmic | 32,06 |
| estructura electrònica | [Ne]3s23p4 |
| estats d’oxidació | -2, +4, +6 |
| densitat | 2,07 g/ml |
| punt de fusió | 112,8ºC |
| punt d’ebullició | 444,67ºC |
| radi iònic (S+2) | 2,19 Å |
| potencial d’ionització, en eV | I: 10,360 |
| II: 23,33 | |
| conductivitat tèrmica (sòlid policristal·lí) (a 25ºC) | 0,00270 W/cm∙K |
| resistivitat elèctrica (a 20ºC) | 2 x 1023 μΩ∙cm |
