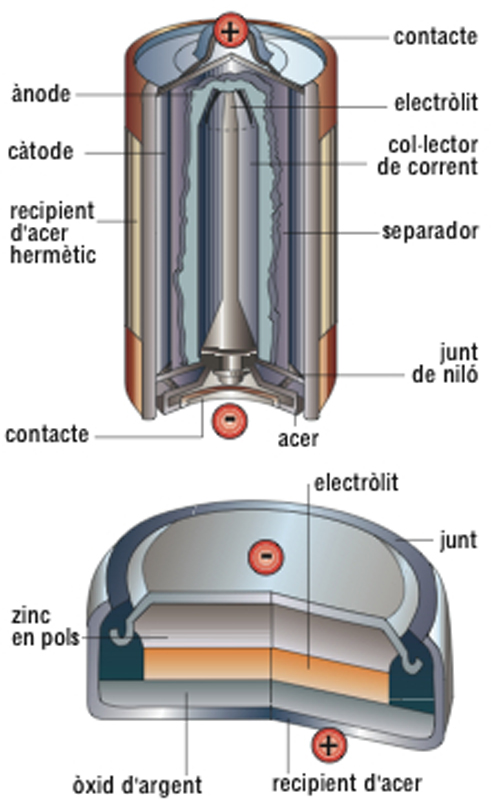
És anomenada també pila elèctrica, pila galvànica o pila voltaica . Essencialment es compon d’un electròlit i dos elèctrodes (positiu i negatiu), que constitueixen un parell voltaic; a més, hi ha el despolaritzador. La primitiva pila de Volta (1793) era formada per una sèrie de discs de coure i zinc disposats alternativament i entre els quals hi havia unes peces de cartó o drap amarades d’àcid sulfúric. Aquesta pila presentava l’inconvenient de polaritzar-se, i per això les posteriors modificacions introduïdes donaren lloc a diversos tipus de piles en les quals hom disposava un despolaritzador. El primer a crear una pila proveïda de despolaritzador fou Grove (1833). El 1836 Daniell ideà un tipus de pila impolaritzable , amb dos líquids. El 1842 Poggendorff ideà la pila de dicromat, que després fou perfeccionada per Grenet. La pila de Bunsen (1842), basada en la de Grove, donà bons resultats, però presentava l’inconvenient de desprendre vapors tòxics. El 1868 aparegué la pila de Leclanché, que és la que ha donat lloc a les utilitzades actualment. També cal esmentar les anomenades piles de concentració , basades en la variació d’energia lliure que té lloc en el transport d’una substància des d’un sistema de concentració elevada a un de baixa concentració. Aquest tipus de pila és el més simple des d’un punt de vista termodinàmic, puix que no implica una reacció química global. N'existeixen dos tipus: les piles de concentració en els elèctrodes , basades en la variació de concentració dels components que constitueixen els elèctrodes, els quals poden ésser de gasos o d’amalgama, i les piles de concentració en l’electròlit , la força electromotriu de les quals és deguda únicament a una variació d’energia lliure per un procés de dilució. Totes aquestes piles, d’electròlit líquid (anomenades piles líquides ), actualment no són utilitzades; hom les ha substituït per les dites piles seques , d’electròlit immobilitzat, la majoria de les quals es basen en la de Leclanché o en la perfeccionada per Féry. En les piles seques corrents el pol positiu és una barra de carbó porós i el negatiu és el mateix recipient, de zinc. L’electròlit és clorur amònic, i el despolaritzador, diòxid de manganès. La tensió és d’1,5 V. Una altra pila seca utilitzada és la de mercuri , on el recipient és el pol positiu, d’acer, i el negatiu és de zinc, situat al centre, i conté a més zincat potàssic; entre els elèctrodes hi ha òxid mercúric i grafit. La tensió, d’1,35 V, es manté durant molt de temps inalterable; són piles de gran duració. Les piles alcalines són formades per un ànode de zinc de gran superfície, un càtode de diòxid de manganès d’elevada densitat i un electròlit d’hidròxid de potassi. Són encapsulades dins un recipient hermètic d’acer amb un recobriment d’argent en els punts de contacte dels pols positiu i negatiu. Presenten una alta eficiència en aplicacions que requereixen cicles continuats d’alimentació, amb corrents relativament elevats. Llur tensió nominal, d’1,5 V, es manté durant molt de temps inalterable; són piles de gran durada. Hom les aplica sobretot a les joguines elèctriques, els magnetòfons de cassette i aparells d’il·luminació de llarga durada. Les piles d’argent , molt similars a les de mercuri, són formades per un càtode d’òxid d’argent, un ànode de zinc i un electròlit d’hidròxid potàssic o sòdic. Llur tensió és d’1,55 V. Són aplicades a les calculadores de butxaca i els rellotges elèctrics de polsera. Les piles de liti són les que presenten la densitat d’energia més alta, la vida útil més llarga i la tensió més alta (3 V i 3,5 V). De llur composició interna no forma part l’aigua, cosa que permet un rendiment a baixes temperatures molt superior al de les altres piles (pot disposar del 50% de la seva capacitat a temperatures de l’ordre de -55°C). En les piles de gas els elèctrodes són impregnats de gas i són submergits en un gas sota pressió. Les piles de cadmi són constituïdes per una amalgama de sodi (pol negatiu), sulfat de cadmi, sulfat mercúric i mercuri (pol positiu). Llur tensió d’1,01864 volts a 20°C és utilitzada com a definició estàndard del volt i és utilitzada com a voltatge de referència en molts circuits.
f
Química