L’acidesa d’un àcid HA en un solvent amfipròtic S, o sigui, la seva força en aquest solvent, ve mesurada per la seva tendència a cedir un protó al solvent, és a dir, per la constant d’acidesa KA:
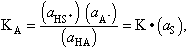
(expressió on ai és l’activitat de l’espècie i i K és la constant de l’equilibri HA + S ⇌ HS+ + A-). La força d’un àcid depèn, doncs, del solvent. En general, resulta còmode d’expressar l’acidesa en unitats logarítmiques, i per obtenir nombres positius hom pren el logaritme de la inversa de KA , que és representat pel símbol pKA:
pKA = -log KA
Com més elevada és l’acidesa, és a dir, com més fort és un àcid, més petit és pKA. L’acidesa d’una solució, per exemple de la solució de HA en S, pot significar dues coses molt diferents: primer, l'acidesa total o acidesa estequiomètrica, determinada per alcalimetria i que és la concentració total de l’àcid HA, dissociat o no, és a dir, la suma de les concentracions de HA i A-; segon, l'acidesa actual o acidesa efectiva, que ve mesurada per aHS+, ja que són els ions HS+ els que determinen les propietats àcides de la solució. Atesa la impossibilitat intrínseca de mesurar les activitats individuals dels ions, aHS+ no pot ésser conegut amb certesa, bé que, en molts casos, pot ésser deduït amb aproximació suficient. En les solucions aquoses, una expressió numèrica de l’acidesa és el pH.