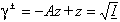Amb les convencions usuals respecte als estats de referència, γ = a/P en el cas dels gasos i γ = a/c en el cas de les solucions. Segons que la concentració sigui expressada en fracció molar, molalitat o molaritat, el valor numèric de γ varia. L’interès dels coeficients d’activitat resideix en el fet que varien molt més lentament que les activitats i es presten millor, per tant, a les interpolacions i extrapolacions. En el cas dels electròlits forts, com que és impossible calcular les activitats individuals dels ions, hom introdueix un coeficient d’activitat mitjà γ±, deduïble de mesures, el qual varia amb la força iònicaI de la solució. La teoria de Debye i Hückel mostra, d’acord amb l’experiència, que, per a un mateix electròlit, el valor de γ± en solució diluïda és constant en totes les solucions d’igual força iònica, i que en solució molt diluïda no depèn de la natura de l’electròlit, sinó només de les càrregues dels ions d’aquest, z+z—, i ve donat per la fórmula