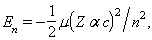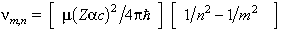Recolza sobre les hipòtesis següents: l’àtom només pot existir en uns certs estats estacionaris, caracteritzats pel fet que el seu electró només pot ocupar unes òrbites (o nivells energètics) ben definides, que, tot i ésser governades per la mecànica clàssica, són determinades per la condició que el moment angular orbital de l’electró sigui un múltiple enter de la constant de Planck reduïda: L =nh, essent h =h/2π; l’emissió i absorció d’energia per l’àtom no es realitza de forma contínua, com demanaria l’electrodinàmica clàssica en explicar el moviment circular (dissipatiu) d’un electró, sinó que es realitza de forma discreta: en passar l’electró d’un estat estacionari Eia un altre Ejés emès (si EjEi) o és absorbit (si Ej> Ei) un fotó d’energia hν = | Ei -Ej |. El model permet d’obtenir les energies dels estats estacionaris dels àtoms hidrogenoides: