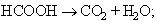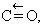És el producte resultant de l’oxidació incompleta del carboni per l’oxigen; és el constituent combustible de diferents mescles gasoses industrials i el reductor gasós més emprat en metal·lúrgia. És preparat industrialment per combustió del carbó amb aire en defecte. En el laboratori és obtingut pur per deshidratació de l’àcid fòrmic: