Fou utilitzat ja pels alquimistes el s XIII per a refinar els metalls preciosos. Geber l’esmentà per primera vegada al s VIII, i fou el primer a obtenir-lo. També fou conegut amb els noms d'esperit de nitre i d'aiguafort. El 1776 A.L.Lavoisier en féu l’anàlisi, i el 1784 H.Cavendish el sintetitzà per l’acció de la guspira elèctrica. És un líquid incolor, d’una densitat d’1,504 g/cm3 a 25°C, d’un punt d’ebullició de 82,6°C i d’un punt de fusió de -41,6°C. És miscible amb aigua en totes proporcions. L’anomenat àcid nítric concentrat és una solució aquosa de concentració pròxima al 65%. L’àcid nítric pur o el de concentració pròxima al 100% és anomenat àcid nítric fumant, perquè conté en dissolució NO₂ i desprèn N₂O₅, que forma fums blancs amb la humitat atmosfèrica, segons l’equació de dissociació 2HNO₃ →N₂O₅ + H₂O. En presència de la llum es descompon lentament i dóna diòxid de nitrogen, que li comunica una coloració groga. És un àcid fort. És també un agent oxidant fort, a causa de la seva facilitat de dissociació en oxigen i peròxid de nitrogen, segons l’equació 2HNO₃ →2NO₂ + 1/₂O₂ + H₂O. Oxida el sofre a àcid sulfúric i reacciona amb tots els metalls (excepte amb l’or, el platí i algun altre), i dóna el nitrat corresponent i òxid nítric. L’àcid nítric concentrat és capaç de passivar alguns metalls, com el ferro i el crom. Reacciona amb substàncies orgàniques i dóna nitrats o nitroderivats. El procediment actual de fabricació és l’oxidació catalítica de l’amoníac (procediment Ostwald):
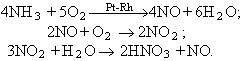
Al laboratori pot ésser preparat per reacció d’àcid sulfúric sobre un nitrat. Les seves aplicacions més importants són la fabricació d’adobs (sobretot nitrat amònic), d’explosius, de plàstics, de colorants, de laques i de nitroderivats.