L’àcid sulfúric pur és un líquid incolor, viscós, fortament corrosiu, que es congela a 10,4°C i té una densitat d’1,84 g/cm3. Bull, en forma d’un azeotrop del 98,3% de riquesa, a 338°C després d’alliberar una petita quantitat de SO3. És soluble en l’aigua en totes les proporcions, i el procés de dissolució va acompanyat d’un gran despreniment de calor. Forma quatre hidrats definits: monohidrat (de punt de fusió 8,62°C), dihidrat (de punt de fusió -38,9°C), hexahidrat (de punt de fusió -38,0°C) i octahidrat (de punt de fusió -62,0°C). L’àcid sulfúric comercial del 98% de riquesa es fon a 3°C. Hom obté àcid sulfúric industrialment mitjançant l’oxidació del diòxid de sofre (SO2), produït generalment per combustió del sofre o per torrefacció de la pirita, i posterior hidratació del triòxid de sofre així format.
Hom duu a terme l’oxidació del diòxid de sofre per mitjà de dos procediments: el mètode de les cambres de plom i el mètode de contacte.
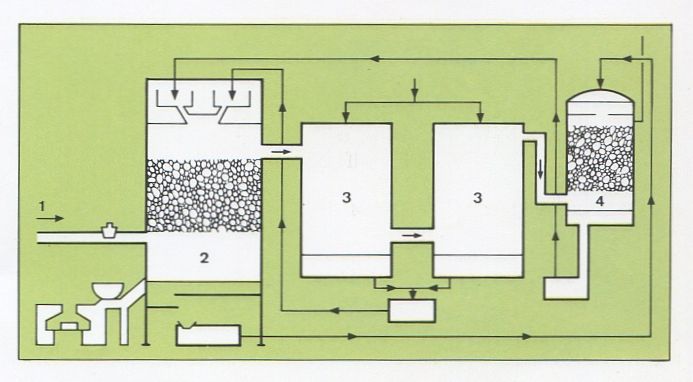
Esquema de la instal·lació per a l'obtenció d'àcid sulfúric pel mètode de les cambres de plom: 1, fums del forn de combustió de pirita; 2, columna de Glover; 3, cambres de plom; 4, columna de Gay-Lussac
En el mètode de les cambres de plom, l’oxidació és catalitzada per òxids de nitrogen i transcorre amb formació intermèdia d’àcid nitrosilsulfúric (HOSO2ONO), d’acord amb la seqüència de reaccions:2SO2+O2+H2O+NO+NO2 → 2HOSO2ONO
2HOSO2ONO+H2O → 2H2SO4+NO+NO2
2SO2+O2+2H2O → 2H2SO4
Mitjançant aquest mètode, hom pot obtenir àcid sulfúric d’una riquesa màxima del 78%, però actualment és gairebé obsolet.
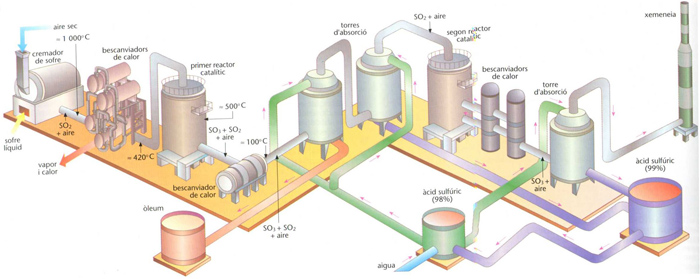
Representació esquemàtica de l’obtenció d’àcid sulfúric, a partir de sofre líquid, per una variant del mètode de contacte (contacte doble), que redueix notablement l’emissió a l’atmosfera de SO2 residual
© Fototeca.cat
En el mètode de contacte hom fa circular una mescla de SO2 i aire a través d’un catalitzador (platí o pentòxid de vanadi) a temperatura elevada, fent reaccionar posteriorment amb aigua, directament o després de la dissolució prèvia en àcid sulfúric, el triòxid de sofre així format. Aquest mètode és pràcticament l’únic emprat actualment i permet l’obtenció tant de l’azeotrop comercial del 98,3% de riquesa com d’òleum.
Des del punt de vista químic, l’àcid sulfúric és un compost molt polar, fortament associat per ponts d’hidrogen, que es troba autoionitzat
2H2SO4 ⇌ H3SO+4+HSO-4
i presenta conductivitat elèctrica. És un àcid molt fort, la primera de les dissociacions del qual és completa en solució aquosa mitjanament concentrada i que presenta, per a la segona dissociació, un pK=1,92. Presenta, d’altra banda, caràcter oxidant i és un poderós deshidratant gràcies a l’estabilitat termodinàmica dels seus hidrats.
Des del punt de vista comercial és, possiblement, la substància inorgànica més important, i la producció anual és actualment de l’ordre dels 50 milions de tones. Les raons principals d’aquesta situació són el seu baix cost i la possibilitat general d’obtenir altres àcids per tractament amb àcid sulfúric de les seves sals. De les nombrosíssimes aplicacions que té, cal esmentar la preparació de l’àcid clorhídric a partir del clorur sòdic, de l’àcid nítric a partir del nitrat de Xile, de l’àcid fosfòric o dels hidrogenofosfats de calci a partir de les apatites i de l’àcid cròmic a partir del cromat sòdic; la preparació, en forma de sulfat, de fertilitzants; l’ús, en síntesi orgànica, com a agent sulfonant i com a deshidratant, en metal·lúrgia com a decapant, i, gràcies a les seves propietats electrolítiques, en la producció d’electricitat (acumulador de plom).
