L’adsorció constitueix un fenomen de la més gran importància per la seva intervenció en els processos vitals, en les reaccions catalítiques i, àdhuc, en certes hipòtesis cosmogòniques, en la formació de l’univers. Fou constatada experimentalment per Fontana (1777), i Kayser proposà el terme (1881). Segons les seves característiques energètiques i cinètiques són definits dos tipus d’adsorció: l’adsorció física i l’adsorció química. L' adsorció física presenta energies d’enllaç petites (tipus forces de Van der Waals) amb valors entre 2 i 6 kcal/mol. És ràpida, i fàcilment reversible. L’adsorció química ofereix energies d’enllaç superiors, entre 10 i 20 kcal/mol (o més), a causa de les transferències d’electrons entre adsorbat i adsorbent. És lenta i, a vegades, difícilment reversible. Segons la natura de la interfície també poden ésser establerts cinc tipus d’adsorció: gas-sòlid, líquid-sòlid, gas-líquid, líquid-líquid i sòlid-sòlid. Les adsorcions més estudiades i utilitzades són l’adsorció de gasos per sòlids i la de líquids per sòlids. La investigació sobre la primera experimentà un gran desenvolupament en el període entre les dues guerres mundials, a causa de la necessitat de protegir-se dels gasos tòxics mitjançant adsorbents adequats i, més tard, per la importància industrial creixent dels processos catalítics, en els quals l’adsorció esdevé essencial. L’adsorció química és íntimament relacionada amb la catàlisi heterogènia, i l’adsorció física amb les tècniques de caracterització de sòlids catalítics, porosos o finament dividits (pigments). L’adsorció en interfície líquid-sòlid és utilitzada industrialment per a la purificació i la clarificació de líquids. En l’equilibri, la quantitat adsorbida Va és funció de la pressió p , i la temperatura T per un sistema donat, adsorbat-adsorbent, és a dir: V a = F ( p, T ). En mantenir constant la pressió, hom obté la isobara i en mantenir constant la temperatura, la isoterma. L’estudi de les isotermes d’adsorció de gasos i vapors ha tingut i té una gran importància, però no ha estat trobada, malgrat els esforços realitzats, una teoria general que expliqui els resultats experimentals satisfactòriament. Langmuir (1916) n'enuncià la primera i deduí una expressió matemàtica per a la isoterma d’adsorció: V = V m ( kp/ 1+ kp ), on V és el volum adsorbit, V m el necessari per a cobrir tota la superfície de l’adsorbent d’una capa de molècules d’adsorbat, i k una constant. L’equació es compleix experimentalment en casos d’adsorció química, però no d’adsorció física. Brunaner, Emmett i Teller desenrotllaren un model similar al de Langmuir i deduïren l’equació:
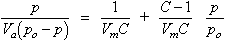
on C és una constant, V m i p tenen els mateixos significats anteriors i p o és la tensió de vapor de l’adsorbat suposat líquid a la temperatura de la isoterma. L’equació és utilitzada per tal de calcular, partint de l’isòmetre experimental, V m , i d’obtenir l’àrea superficial de l’adsorbent. Diverses tècniques experimentals deriven de l’anomenat mètode de BET (Brunaner, Emmet i Teller). Les investigacions de Wheeler conduïren a emprar les isotermes d’adsorció per a elucidar l’estructura porosa dels sòlids i determinar la distribució de dimensions dels porus. És molt utilitzat el mètode de BJH, (Barnett, Joyner i Halenda) i el de Dubinin.