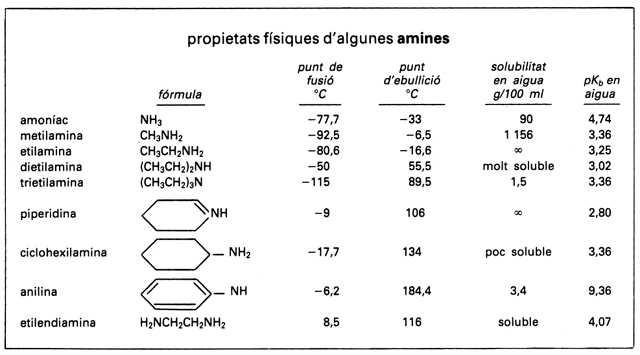
Les amines són primàries RNH₂, secundàries R 1 R 2 NH o terciàries R 1 R 2 R 3 N, segons que hi hagi un, dos o tres hidrògens substituïts. En la nomenclatura sistemàtica, les amines primàries s’anomenen afegint el sufix -amina bé al nom del grup R, bé al nom del compost RH. Exemples: metilamina CH₃NH₂, benzofuranamina
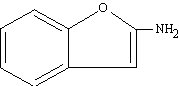
Les amines secundàries i terciàries simètriques s’anomenen afegint els prefixos di- i tri- , i les no simètriques considerant-les productes de substitució de l’amina primària més complicada. Exemples: trietilamina (C₂H₅)₃N, N,N- dimetilciclohexilamina
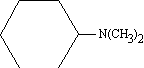
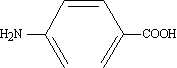
Quan el grup NH₂ no és el principal en la molècula,per a designar-lo és emprat el prefix amino- . Exemple: àcid p -aminobenzoic
Per a diverses amines importants, la IUPAC ha acceptat també noms trivials, tals com anilina, adenina , etc. Les amines primàries i secundàries poden formar enllaços per pont d’hidrogen i tenen, per tant, punts d’ebullició supeiors als dels hidrocarburs de pes molecular similar. Per la mateixa raó, els termes més senzills de la sèrie són solubles en aigua. És característica de les amines primàries i secundàries llur absorció en l’infraroig a 3 500-3 300 cm - 1 , que correspon a la vibració de tensió de l’enllaç N—H. Les molècules de les amines tenen estructura de piràmide trígona. La velocitat d’inversió entre les dues formes possibles
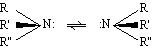
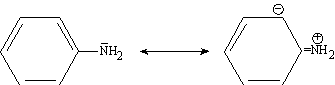
és de 10 3 a 10⁵ cicles per segon, cosa que impedeix llur isolament. Les amines són composts bàsics a causa del parell d’electrons no compartits del nitrogen, que poden captar un protó (base de Lewis). Les amines alifàtiques secundàries són més bàsiques que les primàries, com cal esperar de l’efecte donador d’electrons dels grups alquil. Les amines terciàries, però, no són més bàsiques que les secundàries, puix que el parell d’electrons no compartits del nitrogen queda menys accessible a causa del gran volum dels tres grups alquil. Les amines aromàtiques, com l’anilina, són molt menys bàsiques que les alifàtiques, a causa de la participació del parell electrònic no compartit en la ressonància del nucli aromàtic.
Com a conseqüència de la seva basicitat, les amines donen amb els àcids inorgànics sals cristal·lines d’elevat punt de fusió i molt higroscòpiques. Per tractament amb agents alquilants les amines primàries i secundàries condueixen fàcilment a les terciàries i les amines terciàries donen sals d'amoni quaternari (R₄N⁺X - ). Amb agents acilants les amines primàries donen amides (amida). Així amb clorur de benzensulfonil les amines primàries donen una sulfonamida soluble en àlcalis, les secundàries una d’insoluble i les terciàries no reaccionen (assaig de Hinsberg). Amb àcid nitrós les amines alifàtiques primàries i secundàries donen reaccions complexes, però en el cas de les amines aromàtiques s’aïllen sals de diazoni, punt de partida dels colorants sintètics azoics . Les amines lliures s’oxiden fàcilment i donen òxids d’amina, cosa que les fa útils com a antioxidants. Les amines són preparades bé per reducció de composts nitrogenats de grau d’oxidació superior, tals com nitroderivats, nitrils, imines, amides i oximes:
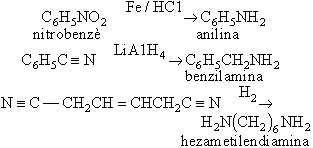
bé per alquilació de l’amoníac, reacció que malgrat donar mescles d’amines primàries, secundàries i terciàries té interès industrial, puix que els diversos productes poden ésser separats amb una adequada destil·lació fraccionada:
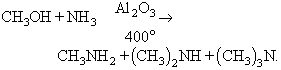
Hom aconsegueix l’obtenció específica d’una amina primària bé mitjançant la degradació de derivats nitrogenats d’Acids: amides (transposició de Hofmann), hidrazides i azides (reacció de Curtius i reacció de Schmidt), o àcids hidroxàmics (transposició de Lossen), la darrera etapa essent sempre la hidròlisi d’un isocianat; bé mitjançant la reacció de Leuckart-Wallach, la reacció de Delépine o la síntesi de Gabriel.