La posició relativa d’aquests dos grups ve indicada per les lletres α, β, γ,..., i ϖ si els grups són als dos caps de la cadena. Els aminoàcids són sòlids cristal·lins, en general poc solubles en aigua i en solvents orgànics, i tenen propietats amfòteres. En solució existeixen en forma de sals internes (formen ions mixtos per migració d’un protó del grup —COOH al grup —NH₂). Al laboratori són preparats per mètodes molt diversos entre els quals un dels més generals és la síntesi de Strecker. Llurs propietats químiques combinen les dels àcids carboxílics i les de les amines, i per tant formen sals amb els àcids i bases forts i donen èsters i amides. Presenten, a més, reaccions de descarboxilació i de desaminació. Per acció de la calor els α es descarboxilen donant amines, els β es desaminen donant àcids α-etilènics i els γ i δ donen lactam.

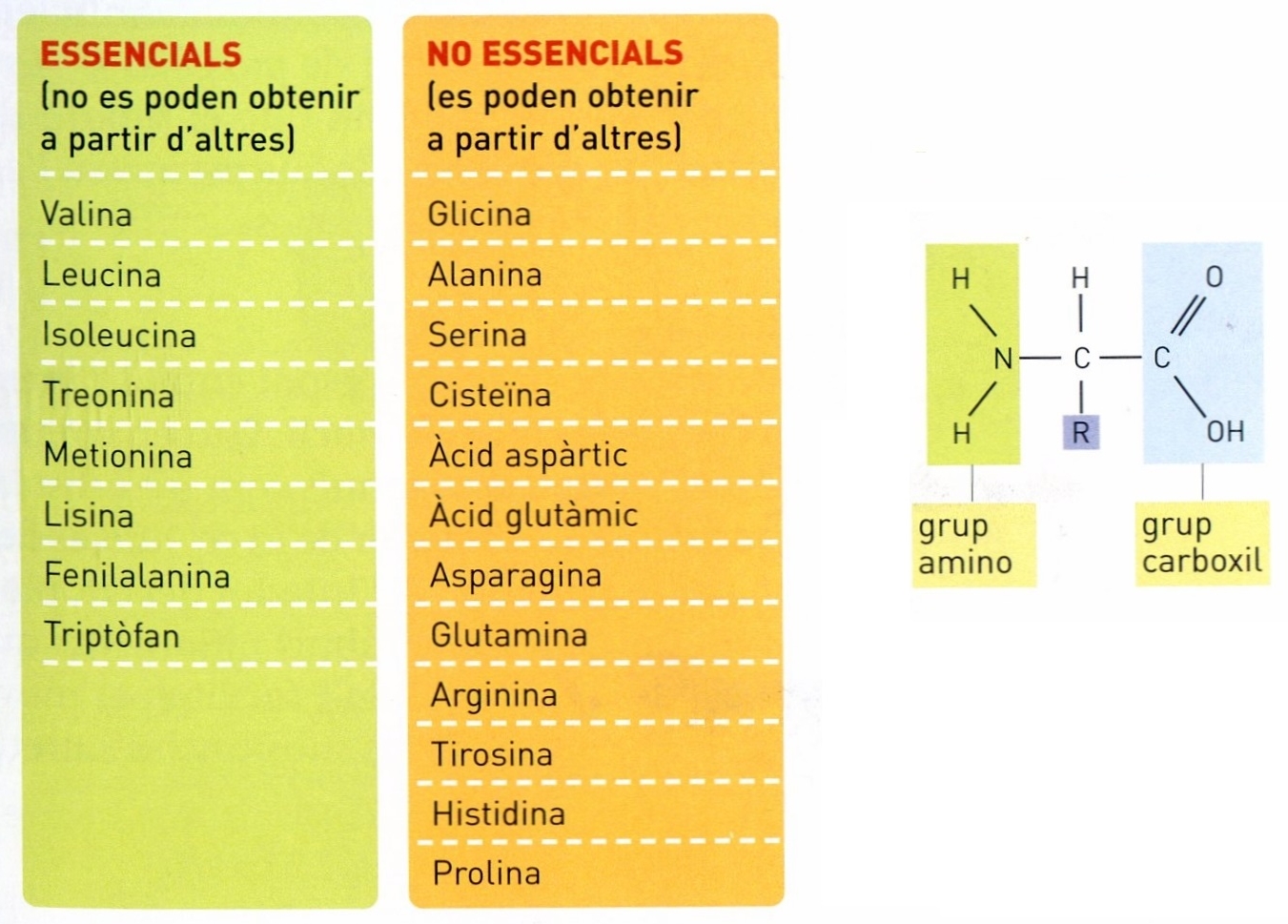
Principals aminoàcids
©
Tenen especial importància els aminoàcids naturals, on la funció amina és gairebé sempre primària. Les unitats estructurals fonamentals de les proteïnes són aminoàcids units entre ells per l’enllaç peptídic. El —COOH d’un aminoàcid s’hi combina amb el —NH₂ d’un altre segons l’esquema:
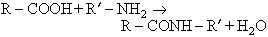
Inversament, la majoria dels aminoàcids naturals són obtinguts per hidròlisi de les proteïnes, la qual es produeix al tub digestiu i en l’autòlisi dels teixits. Els aminoàcids són també precursors de certes hormones, com l’adrenalina; de bases importants, com la histamina i, en les plantes, dels alcaloides. Hom els troba lliures a l’orina, a les matèries fecals i en els formatges fermentats (com a productes del metabolisme i de la digestió intestinal o bacteriana). Els aminoàcids naturals són tots ells α (el grup —NH₂ és al carboni veí del carboxil) i, excepte en la glicina, el carboni α és asimètric. Per tant, els aminoàcids naturals (la glicina exceptuada) són òpticament actius. Levogirs o dextrogirs, tots els presents a les proteïnes pertanyen a la sèrie L, és a dir, tenen la configuració espacial de l’Acid L-làctic. La identificació i determinació quantitativa dels aminoàcids és essencial en la recerca bioquímica. La reacció d’identificació més important és la de la ninhidrina. La determinació quantitativa sol ésser feta mitjançant la valoració al formol de Sørensen o pel mètode de Van Slyke. Existeixen també mètodes específics aplicables a aminoàcids particulars. Mereixen esment els següents: els mètodes microbiològics (que mesuren el desenvolupament de microorganismes que necessiten un aminoàcid determinat per a multiplicar-se); els mètodes enzimàtics (que empren descarboxilases bacterianes específiques que actuen sobre un sol aminoàcid, el qual és valorat mesurant manomètricament el CO₂ format), i els mètodes de dilució isotòpica. Quan hom tracta, però, de determinar tots els aminoàcids presents en una mescla, per exemple, en un hidrolitzat proteic, cal emprar mètodes de fraccionament, que es basen en les diferències de solubilitat en l’aigua i en els solvents orgànics i en les diferències d’acidesa i basicitat, les quals fan possible de realitzar separacions quantitatives mitjançant resines de bescanvi iònic. El mètode més simple i ràpid és actualment la cromatografia sobre paper. A cada aminoàcid correspon un valor de Rf (coeficient de repartiment) i, tractant amb ninhidrina el cromatograma desenvolupat, hom obté taques de color, la posició de les quals és característica. La cromatografia sobre paper dóna especialment bons resultats combinant-la amb la ionoforesi. Tots els 21 aminoàcids presents en les proteïnes animals són necessaris per al creixement i el manteniment de l’organisme humà, però 8 d’entre ells (valina, leucina, isoleucina, treonina, metionina, lisina, fenilalanina i triptòfan) són dits aminoàcids essencials o indispensables, perquè han d’ésser aportats obligatòriament per l’alimentació, mentre que els altres poden ésser sintetitzats per l’organisme, en general a partir d’altres aminoàcids. Amb variacions mínimes, aquesta discriminació val també per als animals altres que l’home. La lisina i la treonina són indispensables de manera absoluta i no tenen substitut. Els altres 6 són indispensables perquè l’organisme no pot sintetitzar llur cadena hidrocarbonada i per tant poden ésser substituïts en l’alimentació pels àcids α-alcohol o α-cetònics corresponents. El metabolisme dels aminoàcids és específic per a cada un d’ells. Els processos generals (en gran part elucidats mitjançant la utilització de carboni i nitrogen marcats) són, d’una part, les reaccions reversibles de desaminació oxidant i d'aminació reductora, la transaminació i la descarboxilació; d’altra part, la destinació del grup NH₂ i la degradació i síntesi de la part hidrocarbonada de la molècula. La desaminació pràcticament té sempre lloc, in vivo, amb oxidació i condueix en dues etapes (deshidrogenació enzimàtica i hidròlisi espontània) a l’àcid α-cetònic. La transaminació consisteix en l’intercanvi del grup NH₂ entre un aminoàcid i un àcid α-cetònic:
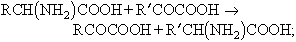
la reacció, possible gràcies a les transaminases (transaminasa), és fonamental en la degradació de la major part d’aminoàcids i en la síntesi d’alguns d’ells; l’Àcid glutàmic i l’Àcid aspàrtic hi tenen un paper especialment important. La descarboxilació és també una reacció enzimàtica; poc important quantitativament, ho és fisiològicament pel paper que fan algunes de les amines obtingudes. Les descarboxilases són molt corrents en els bacteris i donen lloc a la formació d’amines en l’intestí gros i en les putrefaccions. El grup NH₂, quan no és utilitzat per a la síntesi d’altres aminoàcids, passa normalment a l’estat de glutamina, la qual és hidrolitzada al fetge (amb formació d’urea mitjançant el cicle de l'ornitina) i al ronyó (amb formació d’ions amoni). Urea i ions amoni són excretats per l’orina. Des del punt de vista del metabolisme de la cadena hidrocarbonada, els aminoàcids es classifiquen en tres grups: els cetògens, els anticetògens i els que no són ni l’una cosa ni l’altra (metiona, lisina i triptòfan). Els cetogènics comprenen la leucina, la isoleucina, la fenilalanina i la tirosina; tots quatre són metabolitzats donant àcid acetilacètic (cetogènesi); els anticetògens, dits també glucoformadors, comprenen tots els no esmentats; llur degradació dóna productes intermediaris de la síntesi de la glucosa. Pel que fa a llur síntesi, cal considerar només els aminoàcids no indispensables, els quals es divideixen en dos grups: els que provenen d’àcids α-cetònics formats en el metabolisme dels glúcids i lípids (alanina, àcid aspàrtic, àcid glutàmic) i tots els altres, sintetitzables només a partir d’altres aminoàcids.