Líquid mòbil, molt refringent, de forta olor acètica, corrosiu, molt irritant i càustic, que bull a 140°C. Es dissol lentament en aigua, donant l’àcid, i és miscible amb èter, àcid acètic i etanol (a poc a poc, s’hi transforma en acetat d’etil). Era preparat primitivament per reacció de l’acetat sòdic amb clorur d’acetil o de sulfuril i, més tard, a partir de fosgen i d’àcid acètic. Actualment és obtingut per tres procediments: A) Per reacció, en fase líquida, de l’acetilè amb l’àcid acètic glacial, amb sal mercúrica com a catalitzador; es forma diacetat d’etilidè, el qual, destil·lat amb pirofosfat sòdic o clorur de zinc, dóna anhídrid acètic i acetaldehid:
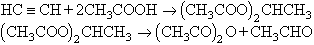
(aquest procediment és cada cop menys utilitzat); B) mitjançant oxidació per aire de l’acetaldehid en fase líquida a lleugera pressió, amb formació intermediària d’àcid peroxiacètic i producció simultània d’àcid acètic. El catalitzador és una mescla d’acetats metàl·lics:
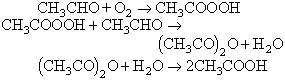
La dilució amb acetat d’etil permet la destil·lació azeotròpica contínua de l’aigua formada, alentint la reacció, però augmentant la proporció relativa d’anhídrid obtingut; C) per reacció del cetè amb àcid acètic glacial:
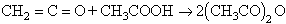
Químicament l’anhídrid acètic és sobretot un agent acilant i deshidratant. No solament acetila els alcohols i les amines, sinó també els hidrocarburs aromàtics per reacció de Friedel i Crafts. Un grup acetil entra a formar part del compost acetilat i l’altre dóna àcid acètic. Com a deshidratant, permet d’obtenir, per exemple, els anhídrids de molts àcids carboxílics menys volàtils que l’acètic. En moltes d’aquestes reaccions serveix al mateix temps de dissolvent. Les principals aplicacions de l’anhídrid acètic són, en primer lloc, la fabricació d’acetat de cel·lulosa i, en segon terme, la d’acetat de vinil, d’acetobutirat de cel·lulosa, d’aspirina i de peròxid d’acetil. A més a més, però, és utilitzat en nombroses altres síntesis de productes orgànics.