Propietats del brom
Hom en coneix dos isòtops naturals de nombre màssic 79 i 81. Es presenta en forma de líquid roig fosc, i els seus vapors, d’olor semblant al clor, són fortament irritants. Forma molècules diatòmiques (Br2), molt estables, que només es dissocien apreciablement per damunt de 1.000°C. És relativament poc soluble en aigua (la solució és anomenada aigua de brom), bé que la solubilitat canvia molt en presència de sals, sobretot de bromurs, amb els quals forma ions complexos, com Br3- i Br5-. És molt soluble en alguns dissolvents orgànics (sulfur de carboni, tetraclorur de carboni, cloroform, benzè, etc.), L’escorça de la Terra conté entorn del 0,00016% de brom (300 cops menys que de clor), en forma de bromurs, que són els composts més estables. Bé que hi ha alguns minerals de brom, com la bromargirita, l’embolita i la iodobromita, aquests només són útils per al benefici de l’argent. El brom és àmpliament dispers per terres, roques, aigües, vegetals, sense formar jaciments propis, i hom l’extreu de les aigües de llacs o mars interiors salats (l’aigua de la mar Morta en conté un 0,57%), de les salmorres naturals (Michigan), o bé de les aigües residuals d’aprofitament de dipòsits salins acumulats per dessecació de grans llacs en períodes geològics llunyans (Stassfurt, Súria, etc.), on els bromurs es troben barrejats amb clorurs. Les tècniques modernes han fet possible d’obtenir-lo econòmicament de l’aigua de la mar, que en conté vers el 0,07%. Per tal de separar-ne el brom, les aigües que el contenen com a bromur són tractades amb clor, en medi àcid, el qual oxida aquest darrer a brom elemental, Br2, que és arrossegat amb vapor d’aigua o amb aire. A Europa, on hom parteix de salmorres riques, és freqüent l’ús del vapor, el qual, en condensar-se, deixa una capa inferior líquida de brom impur, que hom purifica en columnes de destil·lació. Als EUA, on hom tracta generalment l’aigua de mar, pobra en bromurs, el brom de la solució salina és arrossegat amb aire i fixat per mitjà d’un àlcali (carbonat, generalment) i reduït amb anhídrid sulfurós.
El brom comercial, per a ús tècnic, és d’una puresa del 99,5% o més gran, acompanyat de petites quantitats d’aigua, clor i bromur d’hidrogen, i constitueix la primera matèria per a l’obtenció dels composts minerals i orgànics del brom. Als EUA, que produeixen les tres quartes parts del brom mundial, és destinat en un 80% a la fabricació del bromur d’etil, per a corregir la toxicitat dels gasos de combustió de les gasolines etilades. El poder oxidant del brom, menys agressiu que no el clor, és aprofitat per al blanqueig tèxtil i la desinfecció d’aigües. El brom és un element d’electronegativitat elevada, amb un potencial normal Br2 → 2Br- de +1,066 eV, enfront de l’elèctrode d’hidrogen, i els seus composts més estables són els de nombre d’oxidació -1 (bromurs). Per a formar bromurs, el brom elemental reacciona ja en fred amb tots els metalls (llevat del platí i el tàntal), sovint amb molta violència, especialment quan la presència d’humitat impideix al metall de protegir-se amb una capa contínua de bromur. Reacciona directament amb l’hidrogen, amb formació de bromur d’hidrogen, compost covalent en estat gasós o en solvents apolars, però que s’ionitza profundament amb aigua. El brom reacciona directament també amb alguns no metalls com el sofre, el seleni, el tel·luri, el fòsfor i l’arsènic, i indirectament amb l’oxigen.
El brom actua amb el nombre de valència +1 en els composts que forma amb fluor i clor i elements més electronegatius, bé que l’enllaç resulta de caràcter més covalent que no pas iònic. L’ió positiu Br+ sorgeix sovint per dismutació de la molècula Br2 en ions Br- i Br+ en un equilibri que es desplaça si l’ió Br+ pot satisfer la seva avidesa electrònica amb reductors més enèrgics que Br- (com l’amoníac), o bé si pot omplir el seu orbital vacant amb reaccions de substitució de protons en molècules orgàniques (bromacions) o de fixacions d’ions d’hidroxil (formació d’àcid hipobromós, HBrO), reacció que té lloc en solució aquosa. Completant la hidròlisi de Br2 per subtracció d’ió hidroni, H3O+, amb una base, s’arriba a la formació d’hipobromit BrO-, i bromur, Br-. Semblantment, la dissolució heterolítica de Br2 tendeix a completar-se, si hom fixa els ions Br negatius en una sal poc soluble mitjançant òxid d’argent o de mercuri. Quan la reacció amb òxid mercúric és portada a terme en sec o en medi anhidre (tetraclorur de carboni), es forma anhídrid hipobromós, Br2O, que és un gas inestable a la temperatura ordinària. L’àcid hipobromós és un àcid feble (pK = 8,75), no gaire estable, que cedeix el seu oxigen amb un potencial normal de reducció de +1,59 eV i que pot evolucionar fins a àcid bròmic, HBrO3 (segurament amb formació intermèdia d’àcid bromós, HBrO2, reconegut només indirectament), segons la reacció
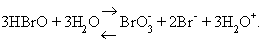
L’àcid bròmic és ja un àcid dels forts (pK = 0,7), només estable en solució. El seu potencial d’oxidoreducció és de +1,52 eV, lleugerament inferior al de l’hipobromós. Les sals, els bromats, són bastant estables a l’estat sòlid. Els anions dels oxoàcids del brom poden ésser considerats, estructuralment, derivats de l’ió bromur, Br-, per coordinació dativa d’aquest a un, dos, tres àtoms d’oxigen, en una sèrie de la forma
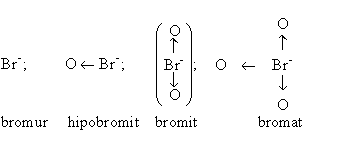
que aclareix la facilitat amb què els hipobromits es desproporcionen a bromurs i bromats.
Taula de les propietats físiques del brom
| nombre atòmic | 35 |
| pes atòmic | 79,904 |
| estructura electrònica | [Ar] 3d10 4s24p5 |
| valències | ±1,3,5 |
| densitat dels cristalls (a 20ºC) | 3,119 g/ml |
| punt de fusió | -7,2ºC |
| punt d’ebullició | 58,78ºC |
| conductivitat tèrmica (del líquid saturat, a 300 K) | 1,22 mW/cm·K |
| resistivitat elèctrica (a 0ºC) | 1,8 x 1012 μ Ω·cm |
| radi iònic (Br+ 1 ) | 1,96 Å [en cristalls] |
| radi metàl·lic | 0,80 Å |
| potencials d’ionització, en eV | I: 11,814; II: 21,8; III: 36 |
| temperatura crítica (Br2) | 588 K |
| pressió crítica (Br2) | 10,3 MPa |
| calor específica (a 25ºC) | 0,474 J/g.K |