Normalment actua amb les valències +2 i +3. El nombre considerable de graus d’oxidació del crom s’explica per l’energia similar que posseeixen els electrons dels orbitals 3 d i 4 s, i per la mobilitat dels cinc electrons desaparellats de l’orbital incomplet 3 d, aptes per a participar, juntament amb l’únic que ocupa el nivell 4 s, en enllaços covalents. Els orbitals buits dels nivells 3 i 4, que fan possibles els salts d’electrons de l’un a l’altre, i viceversa, quan hom els sotmet a una radiació de llum blanca, expliquen també la viva coloració de les sals de crom. En l’escorça terrestre n’hi ha un 0,02%. Fou descobert en un mineral siberià per Nicolas Louis Vauquelin (1797); fou aïllat per primera vegada per Robert Wilhelm Bunsen (1854) i fou obtingut a l’estat pur per aluminotèrmia per Victor Moritz Gold-schimidt (1900). És un metall molt dur, de color blanc blavós, que resisteix bé la calor i una gran part dels agents químics. Els seus minerals principals són la cromita o ferro cromat (FeO · Cr2O3 o FeCr2O4) i la crocoïta (PbCrO4), molt menys abundant. La cromita és sovint reduïda directament pel carboni en el forn elèctric i hom n’obté ferros colats (ferrocroms), molt rics en crom (fins a un 70%), destinats a la fabricació d’acers especials. Per a obtenir els composts purs de crom, el mineral és finament dividit i després escalfat a 900°C amb calç barrejada amb sosa o carbonat de sodi. En presència d’aire, la calç serveix per a facilitar que aquest penetri en la massa i reaccioni. Les reaccions que s’hi produeixen són:
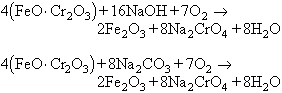
La massa obtinguda és rentada amb aigua, i en la solució el cromat de sodi és transformat en dicromat per l’acció de l’àcid sulfúric:
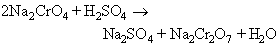
el sulfat de sodi és eliminat concentrant la solució en calent; hom obté, per refredament, la cristal·lització del dicromat de sodi Na2Cr2O7 · 2H2 O en la solució final filtrada. El mateix compost pot ésser obtingut pel procediment Bozel-Maletra, més modern i de rendiment superior, partint de ferrocroms finament polvoritzats, atacats per un lleixiu de sosa dins una autoclau, en calent i amb agitació contínua. El consum d’energia és el mateix en ambdós procediments, però el segon té l’inconvenient greu del desgast ràpid de les hèlices d’agitació en contacte amb el fang abrasiu. El dicromat permet la preparació dels altres composts del crom; hom prepara l’òxid Cr2O3 per reducció amb sofre:
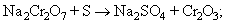
el metall és preparat per aluminotèrmia partint d’una barreja d’òxid (Cr2O3: 100 parts), de triòxid (CrO3: 30 parts) i de granalla d’alumini (45 parts), recoberta d’una capa de fluorita. La reacció és iniciada amb una barreja de pols d’alumini i de peròxid de bari i és prou exotèrmica per fondre tots dos metalls, que se separen per densitat. El règul de crom assoleix el 99,5% de puresa; l’alúmina, de color vermell (traces d’òxid de crom), constitueix el corubí, utilitzat com a abrasiu. La reducció del clorur cròmic pel calci dona un metall més pur. El crom també pot ésser dipositat per electròlisi; industrialment hom opera amb una solució que conté 250 g de triòxid de crom i 2,5 g d’àcid sulfúric per litre, amb ànode de plom:
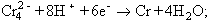
el feble rendiment de l’electròlisi (15%) fa que aquest procediment, massa onerós per a la preparació de grans quantitats de metall, sigui emprat únicament per a recobrir certes peces metàl·liques d’una capa de crom, brillant i resistent a l’oxidació. En el cas de l’acer, el cromatge ha d’ésser precedit d’un couratge o d’un niquelatge, a fi d’augmentar l’adherència de la capa de crom. Inoxidable a la temperatura ambient, fins i tot en aire humit, el crom crema a uns 2.000°C en presència d’oxigen, i forma òxid cròmic verd (Cr2O3). Quan és roent redueix el vapor d’aigua amb formació del mateix òxid, i combinant-se amb els halògens, amb el sofre i amb el nitrogen, dona composts trivalents. A molt alta temperatura es combina amb el carboni i dona una sèrie de composts cristal·litzats. El crom és habitualment utilitzat per a recobrir i protegir acers i altres metalls: hom efectua el cromatge per electròlisi o per via tèrmica (cementació). Ultra les qualitats decoratives i de protecció, el crom electrolític posseeix una forta resistència al fregament (croms durs, croms porosos), que el fa útil també per a recarregar els indrets gastats de certes peces (eines, punxons, burins, eixos, instruments de calibratge, etc.). Hom l’empra per a l’obtenció d’una gran varietat d’aliatges; els aliatges rics en crom (ferrocroms i cuprocroms) serveixen per a l’obtenció d’acer, ferro colat i aliatges cúprics de crom. Els principals acers amb crom o amb níquel-crom són emprats per llur resistència a la corrosió (acer inoxidable), a causa de llur gran duresa (acer per a vàlvules, coixinets, etc.), o per a millorar altres propietats mecàniques. Els aliatges níquel-crom (nicroms) permeten de confeccionar resistències elèctriques destinades a funcionar en medis corrosius. Una tercera part del mineral extret al món és utilitzada exclusivament per a l’obtenció de crom (ferrocroms, acer i ferro colat especials, etc.). La major part del mineral és utilitzada en la indústria química (groc de crom, cromats) per a recobrir l’interior de certs forns metàl·lics. Els principals estats productors són Sud-àfrica, Zimbàbue, l’Índia, les Filipines, el Brasil i Madagascar. Els principals consumidors de crom són els EUA, la Gran Bretanya, Alemanya (RFA), el Japó i França. Malgrat que el cos humà en contingui petites dosis, el crom és tòxic; la ingestió de sals cròmiques o de composts hexavalents produeix una degradació dels teixits renals i del moll dels ossos. Les lesions consecutives a les intoxicacions causades per l’àcid cròmic i pels dicromats són considerades en molts estats com a malalties professionals.
