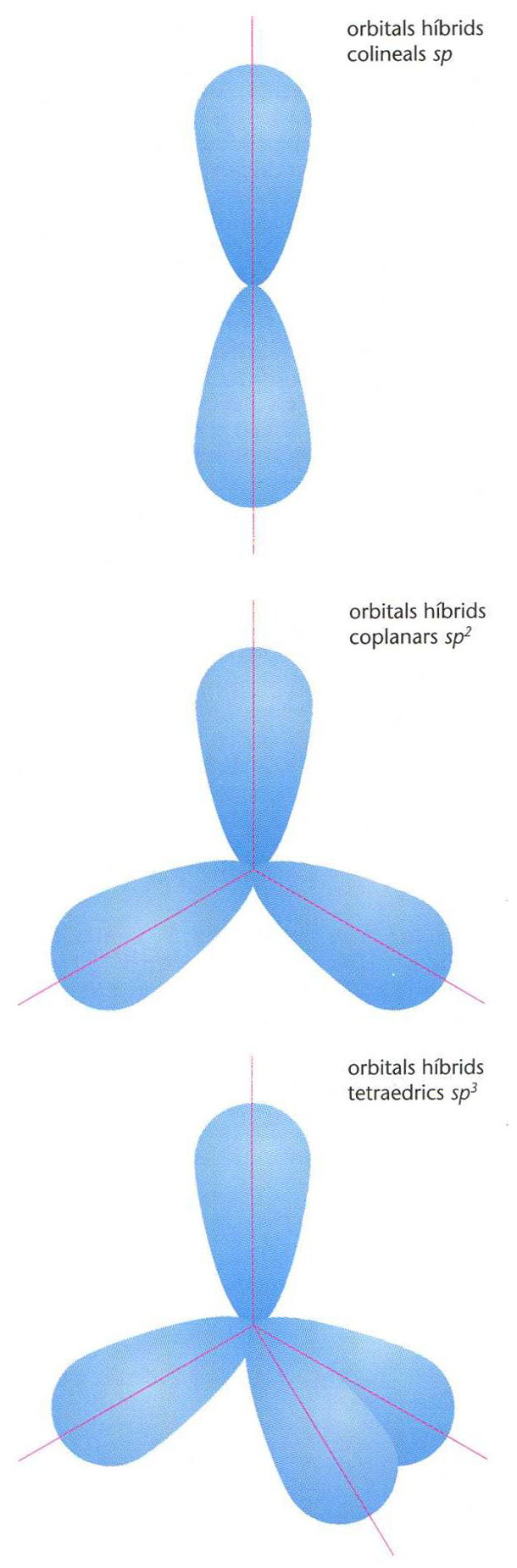
Els orbitals poden hibridar-se en diverses proporcions segons l’enllaç format, per a arribar a una configuració de menor energia, i la geometria d’una molècula és determinada per la hibridació dels enllaços que la formen. Quan un àtom de carboni només té un dels seus orbitals p hibridat amb l’orbital s , hom diu que presenta hibridació sp ; té aleshores dos orbitals sp equivalents alineats i dos orbitals p en plans perpendiculars; aquests àtoms de carboni sp es troben en derivats acetilènics, nitrils, al·lens, etc, és a dir, en composts amb triple enllaç, i amb dobles enllaços acumulats. Quan un àtom de carboni té dos orbitals p hibridats amb l’orbital s , hom diu que presenta hibridació sp 2 ; té tres orbitals sp 2 equivalents coplanaris formant angles de 120°, i l’orbital p que resta és en un pla perpendicular; es troben en molècules etilèniques, carbonils, etc, és a dir, amb doble enllaç. Quan el carboni té els tres orbitals p hibridats amb l’orbital s , hom diu que presenta hibridació sp 3 ; té quatre orbitals sp 3 equivalents dirigits cap als quatre vèrtexs d’un tetràedre regular; el carboni ofereix aleshores quatre enllaços simples. La participació d’orbitals d condueix a hibridacions més complexes: sp 3 d i sp 3 d 2 . La hibridació sp 3 d correspon a una bipiràmide triangular, i la hibridació sp 3 d 2 correspon a un octàedre. Aquestes estructures són molt corrents en els complexos dels metalls de transició. L’estat d’hibridació de cadascun dels àtoms d’una determinada molècula és aquell que, gairebé sempre, forma els enllaços més forts.
f
Química