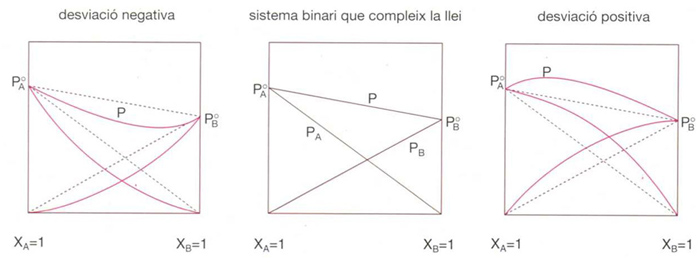
Estableix que el descens relatiu de la pressió de vapor d’un líquid pur (i) en dissoldre-hi una substància no volàtil (s), és proporcional a la fracció molar d’aquesta: (pio- pi)/pio= xs = 1-xi. La llei de Raoult pot ésser també aplicada a mescles líquides binàries i d’ordre superior amb la següent formulació: la pressió de vapor parcial del component i (pi) és igual a la pressió de vapor del líquid i (pio) pur a la mateixa temperatura multiplicada per la seva fracció molar en la mescla pi = pioxi. Molt poques solucions compleixen la llei de Raoult en un interval ample de concentracions. En general hi ha desviacions respecte a aquesta llei, les quals poden ésser tant positives o per excés com negatives o per defecte. Les desviacions positives es presenten quan hi ha diferències de polaritat, longitud de cadena o grau d’associació entre els components, i són les més comunes. Les desviacions negatives es presenten quan hi ha una forta atracció entre les molècules dels components, tal com ocorre quan un d’ells té caràcter àcid i l’altre bàsic, i són més aviat rares. D’altra banda, l’existència de solucions que compleixen la llei de Raoult ha permès una definició de solució ideal com a “qualsevol que compleixi la llei de Raoult en tot l’interval de concentracions i a qualsevol temperatura”.
f
Química