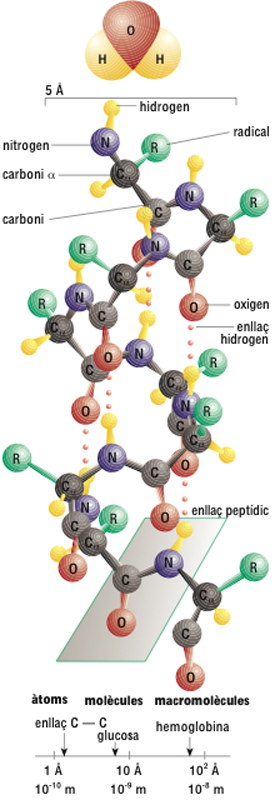
Abans hom definia la molècula, de manera menys general i precisa, com la més petita part d’una substància que podia tenir existència independent i estable conservant encara les seves propietats químiques i certes propietats fisicoquímiques. D’acord amb aquesta definició podien existir molècules monoatòmiques. Les molècules poden ésser formades, bé per un nombre ben definit i en general petit d’àtoms (constituint aleshores entitats elementals anomenades molècules discretes , que solen existir tant en estat gasós com en estat condensat), bé per agregats d’àtoms o ions que existeixen només en estat condensat i s’estenen indefinidament a l’espai (sense altres límits que les dimensions de la mostra), sia en una direcció (cadenes infinites), en dues direccions (capes infinites) o en tres direccions (estructures tridimensionals infinites). En aquests darrers casos les molècules són anomenades molècules gegants . Les molècules d’hidrogen o de glucosa són exemples de molècules discretes. Els sòlids dits moleculars (constituïts per cristalls on les molècules ocupen els nusos del reticle) i els líquids moleculars, normals o associats, són agregats de molècules discretes, i en ells les forces que mantenen la cohesió entre les molècules (forces de van der Waals o enllaços hidrogen) són molt més febles que les forces de valència que enllacen els àtoms a l’interior de la molècula. En conseqüència, les distàncies intermoleculars són netament més elevades que les intramoleculars. Un cristall iònic, una sal fosa, un metall sòlid o fos, un sòlid covalent (és a dir, un sòlid com el diamant o la sílice, en el qual tots els àtoms resten units als veïns més pròxims per enllaços covalents d’igual força) o un polímer fos o en solució són exemples de molècules gegants. Les molècules gegants on els enllaços entre els àtoms són de natura covalent són anomenades també macromolècules (macromolècula); aquest terme és aplicat també al cas de molècules discretes, existents només en estat condensat, que són constituïdes per un nombre molt elevat d’àtoms (cent com a mínim, i sovint diversos milers, com en el cas de les proteïnes). Les macromolècules discretes poden agrupar-se també d’una manera ordenada formant cristalls. En el cas dels gasos les molècules són animades a temperatura ordinària de moviments ràpids de translació i de rotació. En el cas dels sòlids i líquids moleculars hi ha sobretot oscil·lacions al voltant de posicions d’equilibri. Els àtoms que constitueixen les molècules són en posicions geomètricament definides, de manera que les molècules discretes tenen forma i hom pot parlar de distàncies i d’angles d’enllaç, però aquestes distàncies i aquests angles no són absolutament fixos, puix que a l’interior de les molècules hi ha moviments de vibració. Les energies rotacional, vibracional i electrònica de les molècules són quantificades, i els intercanvis d’energia amb radiació electromagnètica donen lloc als espectres moleculars . L’energia total de les molècules, i en particular la dels moviments de vibració dels àtoms a llur interior, depèn de la temperatura. A temperatures prou altes les vibracions esdevenen de tal amplitud que les molècules es dissocien en els àtoms que les componen. Bé que elèctricament neutres, les molècules són formades per àtoms, és a dir, per partícules carregades. Si la distribució de les càrregues elèctriques hi és simètrica, les molècules són dites no polars ; si hi és asimètrica, les molècules són dites polars. Si es té en compte que existeixen uns dos milions de substàncies químiques identificades i que el nombre d’elements químics descobert és només de 116, és important la definició dels seus paràmetres característics com ara l’energia dels seus enllaços, les seves longituds, els seus angles i el moment dielèctric a més de la geometria molecular. La formació de molècules es pot il·lustrar amb una sèrie de models. El més antic és el de Lewis, que explica la formació d’enllaços moleculars per la necessitat d’obtenir per cada àtom una configuració electrònica de gas noble; és la regla de l’octet, que no es compleix sempre. El model de l’enllaç de valència, més actualitzat, considera la superposició (axial o lateral) d’orbitals atòmics de diferents àtoms. Aquesta teoria es complementa amb la introducció de la hibridació d’orbitals, que permet explicar les configuracions espacials de les molècules. Un tercer model és el dels orbitals moleculars, segons el qual els orbitals atòmics s’enllacen entre ells per formar orbitals moleculars, i aquests són compartits pels dos àtoms que formen els enllaços. Els electrons que es troben situats en els orbitals moleculars pertanyen als nuclis de tots dos àtoms alhora. Actualment la investigació molecular se centra cada vegada més en molècules complexes i en macromolècules. Entre les primeres destaquen les biològiques; entre les segones es troben els polímers.
f
Química