Són excloses d’aquesta definició aquelles transformacions nuclears en les quals un element es converteix en un altre (reacció nuclear). Des del punt de vista del nombre de passos implicats, les reaccions són classificades en elementals, quan transcorren en un sol pas, i complexes. En un sentit microscòpic, la reacció elemental
és un procés químicament irreduïble, en el qual ocorre un canvi concertat, mitjançant el qual es passa directament d’un estat estacionari a un altre, sense la intervenció de cap intermedi. D’altra banda, les reaccions complexes
poden sempre descompondre's en una successió de processos elementals ( mecanisme de reacció). Hom sol denominar intermedi de reacció
cadascuna de les espècies, d’existència transitòria en les condicions de reacció en particular, aïllables o no, resultants de cadascuna de les reaccions elementals que componen una reacció complexa, a excepció dels productes finals. Quant a la natura dels intermedis, les reaccions poden ésser classificades en iòniques
i radicalàries
. Dins aquest mateix context, hom acostuma a definir les reaccions concertades
com aquelles que transcorren sense passar per cap intermedi. Això no obstant, és més adient considerar aquest darrer tipus de processos com a reaccions elementals. L’estudi de la reacció química és dut a terme, complementàriament, mitjançant la cinètica química i la termodinàmica. La cinètica química estudia les velocitats amb què ocorren les reaccions i la influència de les condicions experimentals (concentracions dels reactius, temperatura, irradiació, presència de catalitzadors i inhibidors, etc) sobre aquestes velocitats, la qual cosa permet, en darrer terme, la postulació d’un mecanisme de reacció.
D’altra banda, la termodinàmica estudia la reacció tant des de la perspectiva del primer principi, tenint en compte únicament els estats energètics dels reactius, intermedis i productes i mesurant les calors de reacció (llei de Hess), com des de la perspectiva del segon principi, subministrant informació relativa a la possibilitat que una reacció tingui lloc, espontàniament, en una direcció determinada. Això no obstant, el tractament termodinàmic pot ésser únicament aplicat, en rigor, als processos reversibles. Dins aquesta perspectiva global, hom diu que una reacció transcorre amb control cinètic
quan, entre els camins possibles, opera el que presenta un estat de transició de més baixa energia, àdhuc si això implica arribar a productes menys estables termodinàmicament que els que podrien formar-se a través d’altres canvis. Per contra, hom diu que una reacció transcorre amb control termodinàmic
quan, entre tots els productes possibles, es formen preferentment els més estables termodinàmicament, àdhuc si n'existeixen de menys estables que puguin formar-se amb velocitats més grans. També, des del punt de vista de la termodinàmica, les reaccions químiques poden ésser classificades, d’acord amb els canvis energètics que comporta el procés, en endotèrmiques
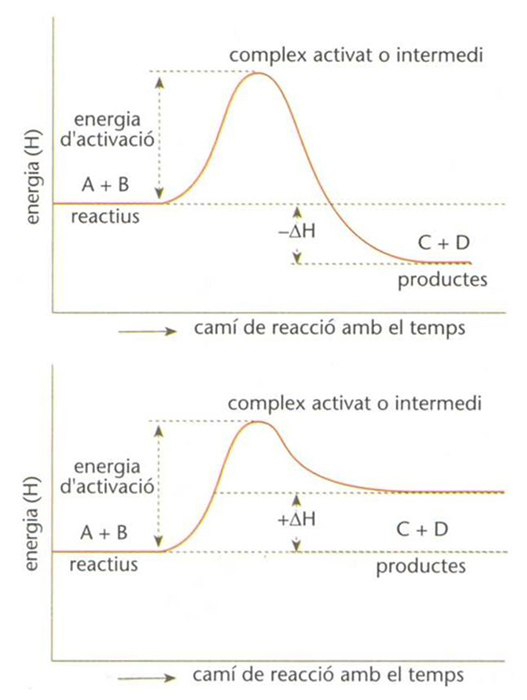
, en les quals s’absorbeix energia, i exotèrmiques
, en les quals s’allibera energia (termoquímica). Des d’un punt de vista pràctic, la gran majoria de reaccions que transcorren de manera total són exotèrmiques. El coneixement dels aspectes termodinàmics de la reacció química i el de la possibilitat de catàlisi en un procés concret són d’una gran importància econòmica. El gran nombre de reaccions químiques possibles fa necessària una classificació d’aquestes en diversos tipus generals. Al llarg del procés històric del desenvolupament de la química, hom ha establert classificacions obeint a criteris molt diversos. Però la complexitat del procés global de la reacció química i la variabilitat dels punts de vista des dels quals hom l’ha enfocat, han fet impossible l’establiment d’una classificació d’abast general. No obstant això, alguns dels criteris emprats han permès d’efectuar classificacions parcials prou clarificadores. D’una banda, les reaccions acidobàsiques
, que apleguen tots aquells processos en els quals es posa de manifest l’acidesa i la basicitat (àcid) en el sentit general de G.N. Lewis. D’altra banda, les reaccions d’oxidoreducció
, que inclouen tots aquells processos en els quals es produeix un canvi en l’estat d’oxidació dels elements que intervenen, en forma elemental o composta, com a reactius (oxidoreducció). També, des del punt de vista de com ocorren les reaccions, hom denomina reaccions en cadena
totes aquelles reaccions complexes en les quals el producte, obtingut a partir d’uns determinats reactius, és alhora un reactiu per a un procés consecutiu, de tal manera que el conjunt d’aquests processos es repeteix, autoalimentant-se, fins a la compleció de la reacció. La majoria de processos radicalaris i de polimerització en són exemples. En un altre context, la divisió clàssica de la química en química inorgànica i química orgànica ha conduït a dues classificacions específiques paral·leles que, en molts casos, denominen de forma diferent processos essencialment idèntics. Així, pel que fa a la química inorgànica, hom parla de reaccions de combinació
, quan distints elements, a través d’una oxidoreducció, reaccionen per formar un producte: reaccions de descomposició
, en les quals una substància es trenca en dues o més substàncies més simples; reaccions de desplaçament,
en les quals un element o grup pren el lloc d’un altre en un compost, alliberant-lo, i reaccions de doble descomposició o metàtesi
, en les quals dos composts reaccionen bescanviant determinats elements o grups i originant-ne dos de nous. Pel que fa a la química orgànica, la gran complexitat d’estructures que estudia comporta també una major amplitud en la classificació de les reaccions.
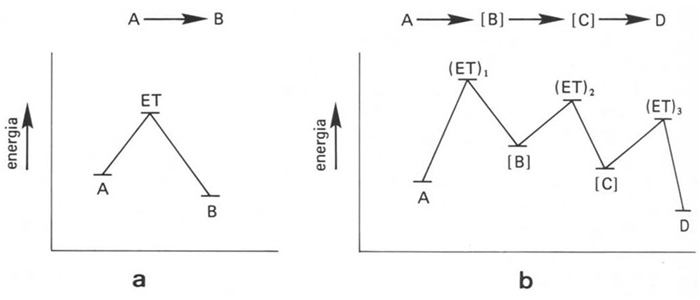
Representació esquemàtica d’una reacció química: a, elemental; b, complexa ([B] i [C] són intermedis de reacció)
© fototeca.cat
Així, resulta útil de fer una classificació atenent el desplaçament dels àtoms o grups al llarg del procés. Així, hom pot parlar de reaccions de substitució
( substitució), en les quals una espècie es fixa sobre un àtom de carboni d’una molècula, amb l’eliminació simultània d’una altra espècie; reaccions d’addició
(addició), en les quals una o més espècies es fixen sobre l’esquelet carbonat; reaccions d’eliminació
, en les quals àtoms o grups s’eliminen de l’esquelet carbonat; transposicions
, en les quals es produeix la reordenació dels àtoms d’una molècula, i reaccions d’inserció
, en les quals un àtom s’insereix entre dos àtoms prèviament units per un enllaç sigma (σ) o pi (π). Anàlogament, hom pot emprar com a criteri de classificació la modificació experimentada per l’esquelet carbonat (condensacions, degradacions, transposicions i interconversions de grups funcionals sense variació de l’esquelet) i la natura de les entitats que intervenen en el procés (iòniques, radicalàries i pericícliques), entre altres. Les diverses classificacions no són, però, excloents entre elles, i troben aplicació en camps concrets atenent la intenció química de cada cas particular. Finalment, i pel que fa a les condicions experimentals en les quals hom realitza les reaccions químiques, hi ha diversos criteris de classificació. Així, atenent l’origen de l’energia d’activació del procés, les reaccions poden ésser classificades en tèrmiques
i fotoquímiques
(fotoquímica). Hom sol també emprar criteris d’homogeneïtat de fase o d’heterogeneïtat del sistema, o bé d’acord amb l’estat físic en el qual ocorren.