Té lloc mitjançant l’establiment d’un enllaç covalent amb un àtom de carboni, desplaçant d’aquest un altre àtom o grup. La racionalització de les reaccions de substitució fou iniciada en el decenni 1940-50 amb els treballs de C.K. Ingold, el qual les classificà en reaccions de substitució nucleofílica i reaccions de substitució electrofílica, atès el caràcter electrònic del reactiu. Les reaccions de substitució nucleofílica ocorren finalment sobre àtoms de carboni saturats; n’és un exemple característic la transformació d’un halogenur d’alquil en un alcohol, d’acord amb l’esquema
HO- +R-Hal →R- OH+Hal-
L’estudi cinètic de les reaccions d’aquest tipus mostra l’existència de dos mecanismes de reacció extrems. L’un d’ells, conegut com a SN1 (substitució nucleofílica unimolecular), implica la formació d’un ió carboni pla, prèviament a l’entrada del reactiu atacant, pel qual fet els substrats òpticament actius que experimenten una reacció d’aquest tipus es racemitzen. L’altre mecanisme, conegut com a SN2 (substitució nucleofílica bimolecular), transcorre a través d’un estat de transició pentacoordinat amb la participació del reactiu que ataca i la del grup desplaçat, pel qual fet els substrats òpticament actius que experimenten una reacció d’aquest tipus sofreixen una inversió de llur configuració en l’àtom de carboni (inversió de Walden).
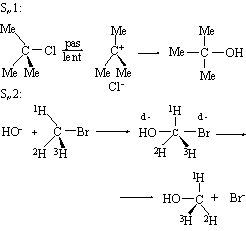
Entre els factors que determinen la preponderància de l’un o de l’altre mecanisme en un cas concret, cal esmentar l’estructura del substrat (així, mentre que els àtoms de carboni primaris afavoreixen el mecanisme SN2, en els terciaris és majoritari el SN1), la natura del reactiu que ataca i la del grup desplaçat, i el dissolvent emprat. Un cas particular de substitució nucleofílica és la SN i, que ocorre amb retenció de configuració a l’àtom de carboni que experimenta la substitució, i que ha estat observada, sobretot, en la reacció d’alcohols amb clorur de tionil, la qual transcorre a través d’un clorosulfit intermedi. Les reaccions de substitució nucleofílica són experimentades per una gran varietat de tipus de composts enfront d’un bon nombre de reactius, i tenen una importància molt rellevant des del punt de vista pràctic.
Les reaccions de substitució electrofílica són experimentades pels composts aromàtics gràcies a llur concentració de càrrega, i n’és un exemple característic la nitració del benzè. Des d’un punt de vista mecànic, la reacció transcorre amb atac inicial de l’espècie electròfila sobre l’anell aromàtic amb formació d’un complex σ, conegut com a intermedi de Wheland, amb pèrdua parcial del caràcter aromàtic, i continua amb eliminació d’un protó del carboni sobre el qual s’ha produït l’atac, amb recuperació de l’aromaticitat, d’acord amb l’esquema
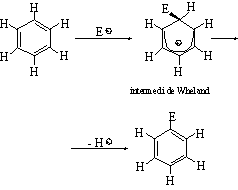
D’aquesta manera, la substitució electrofílica aromàtica és la resultant d’una addició i una eliminació. Les més importants són la nitració, l’espècie activa de la qual és l’ió nitroni (NO2);
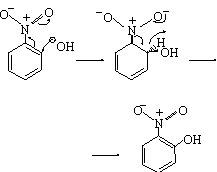
l’halogenació, que ocorre generalment en presència d’àcids de Lewis; la sulfonació, l’agent actiu de la qual és triòxid de sofre (SO3); les reaccions de Friedel-Crafts; i la copulació de fenols amb sals de diazoni. Les substitucions electrofíliques aromàtiques sobre derivats del benzè són afavorides pels substituents que cedeixen càrrega a l’anell i inhibides pels substituents acceptors de càrrega. Pel que fa a l’orientació de la substitució, hi tenen influència tant factors de tipus estèric com de tipus electrònic exercits pels substituents preexistents. D’altra banda, alguns composts aromàtics amb substituents atraients d’electrons són susceptibles d’experimentar un atac nucleofílic, amb producció de reaccions de substitució nucleofílica aromàtica. En són exemples característics l’atac hidroxílic sobre el nitrobenzè i l’aminació de la piridina (síntesi piridínica de Cičibabin). Tanmateix, aquest tipus de substitució és també resultant d’una addició i una eliminació.