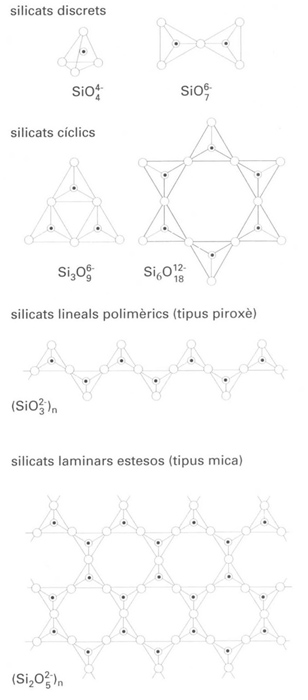
Els silicats poden ésser obtinguts per fusió conjunta de la sílice (SiO2) amb carbonats de metalls alcalins, en forma de mescles complexes. La solubilitat en l’aigua d’aquestes mescles varia proporcionalment a llur contingut en àlcali, i les espècies presents varien des d’anions discrets, com és ara [SiO2(OH)2]2-, fins a espècies polimèriques. D’altra banda, hi ha un gran nombre de silicats, d’ocurrència natural, l’estructura dels quals es basa en la del tetràedre de SiO4, i que gaudeixen d’una gran importància per llurs aplicacions. Hom ha classificat estructuralment els silicats d’acord amb el nombre d’oxígens del tetràedre de SiO4 que són compartits. Quan no n'és compartit cap, hi ha els silicats discrets, els quals contenen l’anió SiO44-, conegut com a ortosilicat i derivat formalment de l’hipotètic àcid ortosilícic H4SiO4 (àcid silícic). Entre aquests cal esmentar la torita (ThSiO4), el zircó (ZrSiO4), els granats, la fenacita (Be2SiO4) i la willemita (Zn2SiO4). Quan l’associació es produeix mitjançant un sol àtom d’oxigen, hom parla també de silicats discrets que contenen l’anió Si2O76-, conegut com a pirosilicat i que ocorre en la thortveitita ((Sc,Y)2Si2O7) i l’hemimorfita (Zn4(OH)2Si2O7 ·H2O). Quant als silicats en què l’associació es produeix mitjançant compartiment de dos àtoms d’oxigen de cada tetràedre de SiO4, poden donar lloc tant a estructures cícliques discretes com a cadenes lineals polimèriques. Ambdós tipus són coneguts genèricament com a metasilicats, però aquesta denominació és inadequada, atesa la inexistència de l’àcid metasilícic (H2SiO3) o d’anions metasilicats discrets (SiO32-). Pel que fa als de tipus cíclic, responen a la fórmula general [SinO3n]2n- i en són coneguts dos: Si3O96-, que ocorre en la benitoïta (BaTiSi3O9), i Si6O1812-, que ocorre en el beril (Be3Al2Si6O18). Les estructures lineals contenen cadenes infinites de tetràedres de SiO4 i poden ésser representades per la fórmula general (SiO32-)n. Aquest tipus d’estructura ocorre en els piroxens, i en són exemples característics el diòpsid (CaMg (SiO3)2), l’enstatita (MgSiO3) i l’espodumena (LiAl(SiO3)2). Molt relacionats amb els piroxens es troben els amfíbols, de fórmula general (Si4O116-)n, l’estructura dels quals es basa en dobles cadenes associades de SiO4 o bé en cadenes simples entrecreuades, i simultàniament hi ha unions mitjançant dos i tres àtoms d’oxigen. N'és un exemple la tremolita (Ca2 Mg5(Si4O11)2(OH)2). Dues propietats propietats comunes als silicats polimèrics lineals són la manca d’influència sobre l’estructura, dins uns certs límits, de la natura dels cations que asseguren la neutralitat elèctrica i una marcada anisotropia, que es posa de manifest en llur consistència fibrosa ( asbest). L’associació mijançant tres àtoms d’oxigen dels tetràedres de SiO4 dóna lloc a estructures bidimensionals esteses que responen a la fórmula general (Si2O52-)n. Aquesta situació ocorre en les miques, i els composts que presenten aquesta estructura són, consegüentment, laminars. Finalment, l’associació mitjançant els quatre àtoms d’oxigen dóna lloc a l’edifici tridimensional de la sílice, caracteritzada per la fórmula (SiO2)n. La substitució d’alguns dels àtoms de silici per àtoms d’alumini en les dues darreres organitzacions esmentades dóna lloc als aluminosilicats, com els feldespats i les zeolites, mentre que la substitució per bor dóna lloc als borosilicats. Els silicats troben una gran varietat d’aplicacions, entre les quals hom pot esmentar la preparació de refractaris, ciments, vidres, tant ordinaris com especials, bescanviadors iònics, tamisos moleculars i aïllants tèrmics.
m
Química