Edició genètica, embrions i disseny de proteïnes
El nombre de tècniques de biologia molecular o cel·lular amb aplicacions en biomedicina està experimentant un gran creixement i un procés d’optimització. Així, el 2017 es van publicar més de 1.200 articles científics en revistes especialitzades en què s’havia utilitzat la tècnica d’edició genètica CRISPR-Cas9 en cèl·lules humanes, que es va utilitzar per primer cop l’any 2014 i que permet reescriure fragments de la seqüència de gens in vivo, inclosos gens humans, de manera poc invasiva, per a corregir mutacions responsables de malalties genètiques.
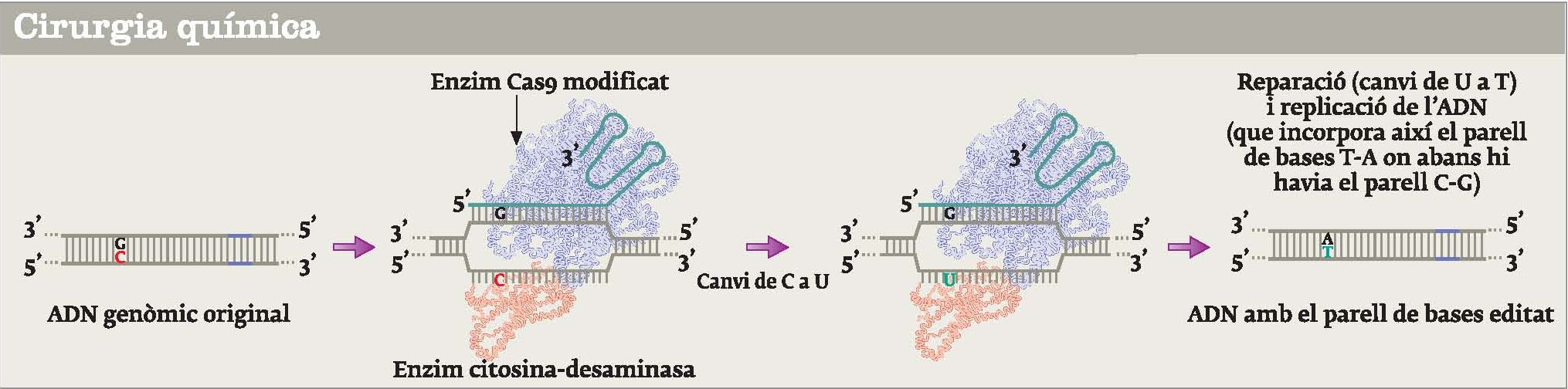
Dibuix esquemàtic del sistema CRISPR-Cas9 modificat que permet minimitzar el risc que es produeixin noves mutacions per error
Tanmateix, el principal avenç de l’any en tècniques d’edició genètica va ser el desenvolupament d’una nova tècnica que, quan s’optimitzi, serà encara menys invasiva i potencialment més eficaç que CRISPR-Cas9. Utilitza un mecanisme propi de les cèl·lules que els permet reparar danys en l’ADN, anomenat sistema d’edició d’un parell de bases. L’equip que el desenvolupa li ha posat el sobrenom de cirurgia química. Fa servir pràcticament els mateixos enzims que el sistema CRISPR-Cas9, però adaptats perquè actuïn sobre un sol nucleòtid de la doble cadena d’ADN, en comptes de tallar-les totes dues.
La idea bàsica és modificar químicament un nucleòtid d’una cadena danyada perquè el sistema natural de reparació d’ADN de la cèl·lula el repari, i, en fer-ho, introdueixi el canvi. Per exemple, es pot desaminar, és a dir, eliminar un grup amina d’un nucleòtid citosina de l’ADN, la qual cosa el converteix en un uracil. L’uracil és un nucleòtid propi de l’ARN i en termes funcionals equival a una timidina de l’ADN. Llavors, la maquinària de reparació de la cèl·lula repara l’uracil i el converteix en una timidina, i a la cadena complementària hi posa una adenina, en virtut de l’aparellament de bases dels nucleòtids (timidina sempre s’aparella a adenina, i citosina a guanina). D’aquesta manera, una parella de nucleòtids citosina-guanina es converteix en timidina-adenina. Per dirigir la maquinària enzimàtica a una citosina concreta es fa servir el sistema CRISPR-Cas9 modificat.
Aquest canvi permet minimitzar el risc que es produeixin noves mutacions per error, i s’ha provat en embrions humans inviables –els únics que legalment es poden utilitzar per a aquests experiments– que, a més, estaven afectats d’una malaltia genètica, la α-talassèmia. Aquesta malaltia, que afecta la producció d’hemoglobina i repercuteix en la major part d’òrgans del cos, és deguda a una mutació puntual que provoca el canvi d’un nucleòtid adenina per una guanina en la posició 28. Es calcula que cada any neixen uns 300.000 nens afectats d’algun tipus de talassèmia, i que el 5% de la població mundial porta un d’aquests gens mutats. En condicions in vitro, es va reemplaçar el nucleòtid defectuós pel correcte mitjançant cirurgia química. A hores d’ara, encara té una eficiència baixa, de només el 20%, però es perfila com una tècnica molt poderosa en biomedicina.
La biologia cel·lular també té interès a mantenir embrions humans en desenvolupament durant diverses setmanes al laboratori, en condicions in vitro. En l’actualitat, el límit legal és de dues setmanes, però fins ara les tècniques disponibles no permetien mantenir-los més enllà de set o vuit dies. El 2017, un equip de recerca va desenvolupar una tècnica que permet arribar a les dues setmanes, i possiblement permetria assolir les quatre setmanes de desenvolupament in vitro, que és el moment en què es comencen a formar els òrgans.
Obtinguts oòcits madurs aptes per a ser fecundats exclusivament en condicions de laboratori, a partir de cèl·lules mare
© ZEISS Microscopy
En un context similar, un altre equip de recerca va obtenir oòcits madurs aptes per a ser fecundats exclusivament en condicions de laboratori, a partir de cèl·lules mare. Van utilitzar una combinació de proteïnes per a estimular l’inici de la diferenciació cap a oòcits –un procés que s’anomena oogènesi–, i després els van posar en contacte amb cèl·lules ovàriques fetals in vitro perquè acabessin el procés de maduració. Ho van fer amb cèl·lules de ratolí, però el procés també es podria aplicar a cèl·lules humanes en determinats casos d’infertilitat femenina.
Un altre camp molt actiu en biologia molecular i cel·lular va ser el disseny de proteïnes perquè facin una funció específica. Fins ara, aquesta ha estat una tasca molt complexa, atesa la gran dificultat de predir quina estructura tridimensional tindran, perquè la funcionalitat de les proteïnes no només depèn de la seqüència d’aminoàcids que les formen, sinó molt especialment de la seva configuració tridimensional. En aquest context, es van desenvolupar programes d’ordinador que permeten predir amb molta precisió l’estructura tridimensional de qualsevol seqüència d’aminoàcids. Això ha permès dissenyar, per exemple, una vacuna universal contra la grip que substitueixi les específiques que cal preparar cada any, i proteïnes que s’acoblen formant una esfera buida que es podria utilitzar de vehicle per subministrar fàrmacs directament a les cèl·lules afectades, sense que interferissin en la resta de teixits del cos.
A tot aquest procés, també hi ha contribuït la possibilitat d’estudiar i observar físicament la dinàmica de les proteïnes en temps real, a través de diverses tècniques, entre les quals cal destacar la criomicroscòpia electrònica, que utilitza electrons en comptes de llum, la qual cosa permet observar diversos milions de vegades les proteïnes augmentades. Aquesta tècnica es va començar a utilitzar al final de la dècada de 1950, i els seus creadors, Joachim Frank, Richard Henderson i Jacques Dubochet, van ser guardonats el 2017 amb el premi Nobel de química.
Societat, genètica i salut
Els canvis socials s’han convertit en part de la selecció natural de la nostra espècie, perquè afavoreixen el manteniment i l’expansió en les poblacions humanes de determinades variants gèniques (al·lels), i també afecten la manera com es regula la funció de molts gens, a través de modificacions epigenètiques. En aquest context, el 2017 es va consolidar el camp anomenat epigenètica social, on conflueixen genetistes, biòlegs, fisiòlegs, antropòlegs, psicòlegs, metges, sociòlegs, filòsofs i historiadors. El seu camp d’estudi és la influència dels aspectes socials, com l’educació, la vida familiar, l’entorn econòmic i cultural, l’alimentació, les situacions personals puntuals o estructurals d’estrès i violència, la pobresa, etc., sobre l’epigenoma de les persones.
L’epigenoma és el conjunt de modificacions epigenètiques que es produeixen a l’ADN o a les proteïnes que l’acompanyen, especialment les histones, com per exemple les metilacions o les acetilacions. Aquestes modificacions no afecten el missatge codificat en els gens (no són, per tant, mutacions), però sí que n’afecten la regulació. Sovint es produeixen en interacció amb el medi ambient, inclòs el social, i poden tenir repercussions sobre la salut física i mental de les persones. Determinades modificacions epigenètiques en gens concrets poden comportar la manifestació de diverses patologies, entre les quals hi poden haver alteracions metabòliques i de comportament. En conseqüència, un dels objectius principals de l’epigenètica social és analitzar com les desigualtats socials contribueixen a la predisposició a manifestar determinades patologies o comportaments en el decurs de la vida, més enllà dels condicionants del genoma.

L’agricultura i els canvis dietètics durant la revolució neolítica han influït en la composició genètica de les poblacions europees
© Fototeca.cat / O. Comas
D’altra banda, es va publicar un estudi sobre com l’agricultura i els canvis dietètics associats amb la revolució neolítica van influir en la composició genètica de les poblacions europees. De les adaptacions produïdes, una de les més importants comprèn una regió genòmica que inclou tres gens que codifiquen uns enzims anomenats insaturases d’àcids grassos (o FADS, segons l’acrònim en anglès). Aquests gens estan implicats en la modificació dels àcids grassos omega-3 i omega-6, unes molècules essencials que cal adquirir amb la dieta, per exemple, per generar àcid araquidònic, que estimula la resposta immunitària i regula els canvis associats amb la inflamació dels teixits.
Respecte als processos inflamatoris, el 2017 es van fer públics descobriments importants pel que fa a la funció dels inflamasomes, uns complexos multiproteics que activen els processos inflamatoris durant la resposta immunitària innata i que van ser descrits per primera vegada l’any 2002. Enguany, es va saber que els inflamasomes també es troben als intestins per respondre als patògens externs que puguin ser de l’aliment o puguin entrar amb ell, la qual cosa els vincula directament a la prevenció d’infeccions intestinals i de determinats tipus d’al·lèrgies alimentàries i de processos inflamatoris normals o patològics associats amb l’alimentació. També es va saber que els inflamasomes influeixen en la composició de la flora intestinal, la qual cosa contribueix a regular la quantitat i el tipus de microorganismes que s’hi troben, i, per tant, indirectament influeixen en els processos de digestió en què intervenen aquests microorganismes. A més, es va conèixer que l’alteració del contingut proteic dels inflamasomes es relaciona amb la susceptibilitat de patir determinades patologies (obesitat, còlon inflamable i esteatosi hepàtica o fetge gras).
Ritmes circadiaris
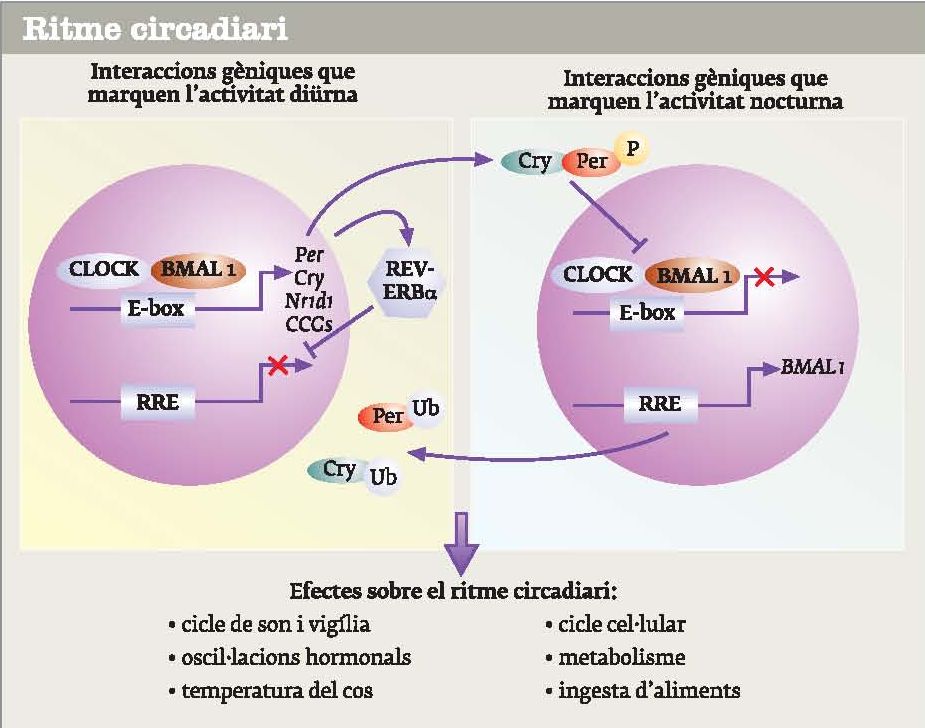
La maquinària genètica bàsica que regula el ritme circadiari la formen quatre gens principals, i més d’una cinquantena contribueixen a refinar-lo
El premi Nobel de medicina i fisiologia va ser per als investigadors Jeffrey Hall, Mi-chael Rosbash i Michael Young, pels seus treballs sobre cronobiologia, és a dir, la ciència que estudia els ritmes biològics de caràcter endogen, generats per les adaptacions biològiques dels éssers vius als cicles geofísics, principalment al cicle dia/nit. Aquests ritmes biològics, anomenats circadiaris, no són una reacció als canvis externs, sinó una anticipació a aquests canvis.
Abans d’iniciar el treball pel qual han estat guardonats, ja se sabia que els organismes vius, inclosos els humans, tenen un rellotge intern biològic que els permet anticipar-se i, per tant, adaptar-se als canvis rítmics habituals del dia, però se’n desconeixia la base. Per exemple, se sabia que l’hipotàlem fa que l’escorça suprarenal iniciï la producció de cortisol, l’hormona de l’estrès, una estona abans que es faci de dia; que els melanòcits de la pell incrementen la producció de melatonina abans que el sol pugi des de l’horitzó; que el cervell comença a produir melatonina, la neurohormona de la son, una estona abans d’anar a dormir, i que molts aspectes fisiològics com la pressió sanguínia i la temperatura corporal experimenten canvis rítmics diaris.
L’any 1971, el biòleg Seymour Benzer va identificar en drosòfiles (mosques de la fruita o del vinagre) tres mutacions genètiques que escurçaven, allargaven o eliminaven el ritme circadiari, però no va poder identificar-hi els gens implicats. L’any 1984, utilitzant també drosòfiles, Hall, Rosbash i Young van aïllar per primera vegada un gen que controla el ritme circadiari, i el van anomenar period. Aquest gen codifica una proteïna que s’acumula a l’interior de les cèl·lules durant la nit, i que es va degradant durant el dia. La interacció d’aquesta proteïna amb el material genètic del nucli permet regular l’activitat gènica i fer que s’anticipi als canvis del cicle dia/nit.
Posteriorment van identificar altres gens implicats en la regulació i la modificació del ritme circadiari, els quals no tan sols permeten mantenir-lo, sinó també modificar-lo en funció dels canvis externs, com per exemple després d’un viatge a una altra zona horària. Per això, durant el conegut jet lag s’alteren les funcions biològiques, atès que el ritme circadiari endogen anticipa canvis que no es corresponen amb l’exterior.
Actualment, se sap que la maquinària genètica bàsica que regula el ritme circadiari la formen quatre gens, que interactuen en les neurones d’una zona del cervell anomenada nucli supraquiasmàtic. Els gens Clock i BMAL1 produeixen sengles proteïnes que s’ajunten i formen un dímer, que entra al nucli cel·lular. Dins el nucli activen uns gens anomenats cry i per (de period, el primer que van identificar Hall, Rosbash i Young). Llavors, les proteïnes que sintetitzen cry i per inhibeixen el funcionament de Clock i BMAL1. D’aquesta manera, quan hi ha molt Clock i BMAL1 tambées fa molta quantitat de cry i per, però llavors cry i per inhibeixen la síntesi de Clock i BMAL1, i, en conseqüència, també disminueix la producció de cry i per. Llavors, quan manquen cry i per, cessa la inhibició i es tornen a fabricar Clock i BMAL1, que es tornen a acumular al nucli per activar novament cry i per i, aleshores, el cicle, que dura aproximadament 24 hores, torna a començar. Malgrat que aquests siguin els quatre gens principals, actualment se’n coneixen més de cinquanta que contribueixen a refinar-lo.
Aquest rellotge biològic regula funcions crítiques dels organismes, com ara el comportament, els nivells hormonals, els períodes de son i de vigília, i la temperatura corporal i el metabolisme. Treballs posteriors han demostrat que els desajustos temporals entre l’entorn i el rellotge biològic, com per exemple els que es produeixen en els treballadors que canvien sovint el torn de feina o en les persones que viatgen sovint entre fusos horaris molt diferents, alteren l’homeòstasi corporal i incrementen el risc de patir determinades malalties cardiovasculars, metabòliques (obesitat, diabetis), mentals (depressió, estrès crònic) i, fins i tot, càncer, entre d’altres. Actualment és un tema de recerca molt actiu, per les implicacions que té en el camp de la salut i en la prevenció de riscos laborals. L’any 2017, per exemple, es van publicar més de 1.300 articles científics en revistes especialitzades.